William E. Moerner
| William Moerner | |
 William Moerner 2013. | |
| Född | 24 juni 1953 Pleasanton i Kalifornien, USA |
|---|---|
| Nationalitet | Amerikan |
| Forskningsområde | Kemi, tillämpad fysik, biofysik |
| Institutioner | Stanford University |
| Alma mater | Washington University in St. Louis, Cornell University |
| ORCID | 0000-0002-2830-209X |
| Känd för | Nanoskopi, fluorescensmikroskopi |
| Nämnvärda priser | Wolfpriset i kemi (2008) Irving Langmuir Award (2009) Peter Debye Award (2013) Nobelpriset i kemi (2014) |
William Esco Moerner (även W.E. Moerner), född 24 juni 1953 i Pleasanton i Kalifornien, är en amerikansk fysiker och kemist. 2014 tilldelades han Nobelpriset i kemi tillsammans med Eric Betzig och Stefan Hell "för utveckling av superupplöst fluorescensmikroskopi".[1][2]
Moerner studerade vid Washington University där han avlade bachelorexamen i flera huvudämnen samtidigt 1975 (Bachelor of Science, B.S. i fysik, B.S. i elektroteknik och A.B. i matematik) och fortsatte sedan till forskarutbildning i fysik vid Cornell University där han avlade en masterexamen (Master of science, M.S.) 1978 och Ph.D.-examen 1982. Han arbetade vid IBM Research 1981–1995, var därefter professor i fysikalisk kemi vid University of California, San Diego 1995–1998, och har därefter varit professor i kemi vid Stanford University sedan 1998.[3]
Han har framför allt uppmärksammats för utveckling av enmolekyl-spektroskopi, men forskar även inom bland annat biofysik och nanoteknik.
Moerner är ledamot av American Academy of Arts and Sciences sedan 2001, av American Association for the Advancement of Science sedan 2004 och av The National Academy of Sciences sedan 2007. Han tilldelades Wolfpriset i kemi 2008 tillsammans med Allen Bard.[3]
Priser och utmärkelser i urval
- National Winner of the Outstanding Young Professional Award, 1984[4]
- IBM Outstanding Technical Achievement Award for Single-Molecule Detection and Spectroscopy, 1992
- Wolfpriset i kemi, 2008[5]
- Irving Langmuir Award in Chemical Physics, 2009
- Pittsburgh Spectroscopy Award, 2012
- Peter Debye Award in Physical Chemistry, 2013[6]
- Nobelpriset i kemi, 2014
Källor
- ^ Kungliga Vetenskapsakademien (8 oktober 2014). ”Nobelpriset i kemi 2014”. Pressmeddelande. Läst 12 oktober 2014.
- ^ ”The Nobel Prize in Chemistry 2014 - Surpassing the limitations of the light microscope”. Nobelprize.org. Nobel Media AB. 8 oktober 2014. http://www.nobelprize.org/nobel_prizes/chemistry/laureates/2014/press.html. Läst 12 oktober 2014.
- ^ [a b] ”Congratulations Professor W. E. Moerner! Chemistry Nobel Laureate, 2014”. Stanford.edu. Stanford University – Department of Chemistry. https://chemistry.stanford.edu/. Läst 12 oktober 2014.
- ^ ”Eta Kappa Nu. Outstanding Young Professional Award. Past Award Recipients”. IEE.org. Institute of Electrical and Electronics Engineers. http://hkn.org/awards/oyece_past_recipients.asp. Läst 12 oktober 2014.
- ^ ”Allen J. Bard Winner of Wolf Prize in Chemistry - 2008”. wolffund.org. Wolf Foundation. http://www.wolffund.org.il/index.php?dir=site&page=winners&cs=11&language=eng. Läst 12 oktober 2014.
- ^ ”ACS 2013 National Award Winners”. ACS. http://cen.acs.org/articles/90/i34/ACS-2013-National-Award-Winners.html. Läst 12 oktober 2014.
| |||||||||||||||||||
Media som används på denna webbplats
Författare/Upphovsman: User:Gusme (it:Utente:Gusme), Licens: CC BY-SA 3.0
Vector image of the Nobel prize medal
Författare/Upphovsman: Kevin Lowder, Licens: CC BY-SA 3.0
photograph of Professor W.E. Moerner of Stanford University, taken at an awards dinner at Washington University in Saint Louis on April 18, 2013.
Författare/Upphovsman: Andy Nestl, Licens: CC BY-SA 3.0
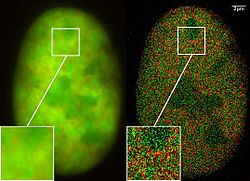
GFP superresolution, optical nanoscopy ( Christoph Cremer, emeritus at Heidelberg university [1])
View of a nucleus of a bone cancer cell: using normal high resolution fluorescence microscopy, it is not possible to distinguish details of its structure (image on the left). Using the two Color Localization Microscopy 2CLM (image on the right) it is possible to localize 70,000 histone molecules (red: RFP-H2A) and 50,000 chromatin remodeling proteins (green: GPF-Snf2H) in a field of view of 470 µm2 with an optical depth of 600 nm. Common fluorescence markers were used.
2CLM is the only optical nanoscopy method that allows position based co-localization of single molecules at high density in a wide field of view using conventional fluorescent proteins such as GFP, YFP, RFP, or other conventional fluorochromes.
Due to its high optical single molecule resolution, 2CLM allows significantly more precise analyses of potential protein interactions than FRET-(Fluorescence Resonance Energy Transfer) technology, which is at present the preferred method for such investigations. This is of particular significance in studies of biomolecular machines (BMMs) within cells: Single BMMS can be analysed, including the number of molecules of a given type; distances between proteins in these BMMs often are substantially greater than those that can be analyzed by FRET (restricted to a maximum distance of only a few nm).
Possible to use conventional, well established and inexpensive fluorescent dyes, from the GFP group, and its dye variants, to the well-known Alexa and fluorescein dyes. Fundamental to SPDMphymod are blinking phenomena (flashes of fluorescence), induced by reversible bleaches (metastable dark states). Individual molecules of the same spectral emission color can be detected.
Publikation: Manuel Gunkel, Fabian Erdel, Karsten Rippe, Paul Lemmer, Rainer Kaufmann, Christoph Hörmann, Roman Amberger and Christoph Cremer: Dual color localization microscopy of cellular nanostructures. In: Biotechnology Journal, 2009, 4, 927-938. ISSN 1860-6768



