van der Waals lag
van der Waals lag är en generalisering och förbättring av den ideala gaslagen. Lagen formulerades av Johannes van der Waals och tar hänsyn till två faktorer som inte beaktas i den ideala gaslagen:
- Attraktionskraften mellan molekylerna
- Volymen för molekylerna
van der Waals lag ger en bättre beskrivning av en gas vid höga tryck då gasen blir så tät att man måste räkna med gasmolekylernas egenvolym och ta hänsyn till de små attraktiva krafter som råder mellan molekylerna.
van der Waals lag:
där
- p = tryck
- V = volym
- n = substansmängd i mol
- R = allmänna gaskonstanten (8,3145 J mol−1 K−1)
- T = absolut temperatur i kelvin
- b = volymen för molekylerna per mol. För en monoatomisk gas är det där är Avogadros konstant och van der Waalsradien
- a = växelverkan mellan molekylerna
Externa länkar
 Wikimedia Commons har media som rör Van der Waals lag.
Wikimedia Commons har media som rör Van der Waals lag.
| |||||
Media som används på denna webbplats
Författare/Upphovsman: User Marc Lagrange on it.wikipedia, Licens: CC BY-SA 3.0
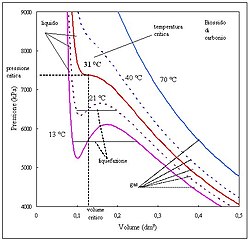
Questo grafico pressione-volume rappresenta le isoterme relative al biossido di carbonio in prossimità del punto di liquefazione. Le curve sono state calcolate utilizzando la legge di Van der Waals ed il grafico è stato realizzato in Excel.
L'autore del grafico ha anche effettuato l'upload dell'immagine (non ci sono quindi problemi relativamente al copyright)