Tiosulfat

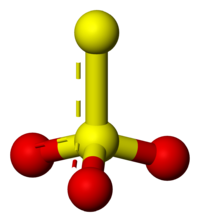
Tiosulfat kallas jonen S2O32–. Den bildas genom reaktion mellan sulfit och svavel i kokande vatten eller genom ofullständig oxidation av sulfider. Det förekommer naturligt i heta källor och gejsrar.
Egenskaper
Tiosulfater är bara stabila i basiska eller neutrala lösningar. I en sur lösning reagerar det med H+-jonerna och sönderfaller till svaveldioxid, svavel och vatten.
Tiosulfater korroderar lätt metaller, i synnerhet stål och även rostfritt stål. Stållegeringar behöver innehålla molybden för att bli motståndskraftigt mot tiosulfat.
De båda svavelatomerna har mycket olika laddningar vilket gör tiosulfater polära.
Användning
Tiosulfater reagerar med halogener vilket gör att de används för avklorering av vatten och för att neutralisera blekmedel.
Reaktionen med jod i kaliumjodidlösning ger tetrationat i en väldefinierad reaktion:
2 S2O32− (aq) + I3- (aq) → S4O62− (aq) + 3 I− (aq)
Jod kan upptäckas i mycket små mängder genom tillsats av stärkelse. Detta är basen för en grupp klassiska analyser, betecknade jodometri. Så kan man t.ex. bestämma tvåvärd koppar i lösning genom att tillsätta kaliumjodid. Kopparn faller ut som kopparjodid (kopparn envärd) efter oxidation av en ekvivalent mängd kaliumjodid till jod (i lösning som I3-). Joden titreras sedan med tiosulfat. Mängden oxiderbart material i vatten kan bestämmas genom tillsats av ett lite överskott oxidationsmedel. Vid tillsats av kaliumjodid ger överskottet oxidationsmedel en ekvivalent mängd jod, som kan titreras tillbaka med tiosulfat.
En annan viktig användning av tiosulfat vid fotografi med silversaltsemulsioner var fixering av den framkallade bilden genom behandling av filmen eller fotopappret med lösning av tiosulfat (fix), som bildar komplex med silvret i silverjodid eller silverbromid i emulsionen och löser ut det men lämnar det silver, som har reducerats ut av framkallaren, kvar i emulsionen. Fixet måste sedan tvättas bort mycket noga, eventuellt brytas ned med väteperoxid, för att bilden inte skall missfärgas.
Se även
Media som används på denna webbplats
Structure of the thiosulfate ion

