Tuberkulos
| Tuberkulos | |
| Latin: tuberculosis | |
| Klassifikation och externa resurser | |
|---|---|
| ICD-10 | A15-A19 |
| ICD-9 | 010-018 |
| OMIM | 607948 |
| DiseasesDB | 8515 |
| Medlineplus | 000077 000624 |
| eMedicine | med/2324 emerg/618radio/411 |
| MeSH | svensk engelsk |
| 1177 Vårdguiden | lungor-och-luftvagar/inflammation-och-infektion-ilungor-och-luftror/tuberkulos--tbc/ |
Tuberkulos,[a] ofta förkortad TBC[2], tbc[3] eller TB[4], är en infektionssjukdom som vanligtvis orsakas av tuberkelbakterien Mycobacterium tuberculosis.[5] Tuberkulos drabbar framför allt lungorna men kan även angripa organ som centrala nervsystemet, könsorganen, blodomloppet, skelettet, leder eller huden. Tuberkelbakterien upptäcktes och renodlades år 1882 av Robert Koch, som genom djurexperiment även påvisade att den var orsaken till tuberkulos. För denna bedrift tilldelades han Nobelpriset i fysiologi eller medicin år 1905.
De klassiska symtomen på tuberkulos är kronisk hosta med blodigt slem, feber, nattlig svettning och viktförlust. Infektion i andra organ kan ge en rad olika symtom beroende på vilket organ som är drabbat. Medicinsk diagnos av tuberkulos baseras främst på röntgenbilder av lungorna och tuberkulintest på huden. Mikroskopundersökning och bakterieodling av kroppsvätskor kan också användas. Tuberkulosbehandlingen är långvarig och omständig och kräver många månaders intag av olika sorters antibiotika. Människans eget immunförsvar kan inte oskadliggöra tuberkelbakterien, utan i stället bildar makrofager och lymfocyter inflammatoriska härdar i lungorna, som går under namnet granulom. Ett granulom är en nisch där bakterier kan växa och spridas, eller där värdens immunförsvar försöker förhindra bakteriell spridning genom att bidra immunceller runt bakterierna.[6] Tuberkulos förebyggs genom screeningtester och vaccinering, oftast med BCG-vaccin.
Tuberkulos sprids genom luften när människor med sjukdomen hostar, nyser eller spottar. En fjärdedel av världens befolkning har infekterats med M. tuberculosis och infektionstakten uppskattas till en person per sekund i världen. De flesta infekterade kommer dock aldrig att utveckla aktiv tuberkulos utan asymtomatisk latent infektion är den vanligaste formen. Omkring en på tio av dessa latenta infektioner utvecklas så småningom till en aktiv sjukdom som, om den inte behandlas, dödar mer än hälften av sina offer.[7] Tuberkulosfallen är långt ifrån jämnt utspridda över världen. I många länder i Asien och Afrika har 80 procent av befolkningen positivt utslag i tuberkulintest, medan runt 5–10 procent har det i USA.[5] Sjukdomen förekommer även hos djur och är en zoonos, alltså en sjukdom som är överförbar mellan djur och människor. Bland djur finns också de zoonosa formerna aviär tuberkulos (M. avium) och bovin tuberkulos (M. bovis).
I Sverige var BCG-vaccination tidigare allmänt rekommenderad, men sedan 1975 rekommenderas endast riskgrupper att vaccinera sig. De allra flesta som insjuknar i tuberkulos i Sverige idag (2015) har bakgrund i länder där tuberkulos fortfarande är vanligt förekommande.
Historia

Tuberkulos har funnits hos människor sedan åtminstone forntiden.[8] De tidigaste otvetydiga spåren av Mycobacterium tuberculosis är i lämningar av en 17 000 år gammal bison.[9] Om tuberkulos har sitt ursprung hos boskap och överfördes till människor eller om de två tuberkulosformerna har en gemensam förfader hos en tidigare art är för närvarande oklart.[10] Det är dock klarlagt att människans M. tuberculosis inte är en direkt avkomling till boskapens M. bovis, som tycks ha utvecklats senare.[11] Skelettrester visar hur förhistoriska människor under neolitisk tid hade tuberkulos[12] och spår av tuberkulos har även hittats i mumiers ryggrad från 3 000–2 400 f.Kr.[13] Phthisis är en grekisk term för tuberkulos och Hippokrates identifierade omkring 460 f.Kr. phthisis som den mest utbredda sjukdomen på den tiden; den var nästan alltid dödlig, med feber och blodiga upphostningar som symtom.[14] Genetiska studier indikerar att tuberkulos fanns i Amerika på 100-talet e.Kr.[15] I Sydamerika var de första spåren av tuberkulos kopplade till Paracaskulturen (750 f.Kr–100 e.Kr.).[16]
Den pulmonella formen som associeras med tuberkelbakterierna etablerades som en patologi av Richard Morton 1689,[17] men på grund av att sjukdomen har så många symtom identifierades tuberkulos som en enskild sjukdom först under 1820-talet och sjukdomen benämndes "tuberkulos" först 1839 av Johann Lukas Schönlein.[18] Mellan 1838 och 1845 tog ägaren av Mammoth Cave, John Croghan, med sig flera patienter som drabbats av tuberkulos till en grotta i hopp om att kunna bota sjukdomen med hjälp av en konstant temperatur och renande luft, men patienterna avled inom ett år.[19] Hermann Brehmer öppnade det första sanatoriet för tuberkulos 1859 i Sokołowsko, Polen.[20]
Hudtuberkulos kunde botas med ultravioletta ljusstrålar. För denna upptäckt fick Niels Ryberg Finsen nobelpris 1903. Vårdplatser där man kunde vistas i solljus ordnades och behandlingarna var positiva men försvann då medicin i stället ersatte ljusbehandlingen.

Tuberkelbakterien M. tuberculosis, orsaken till tuberkulos, upptäcktes och beskrevs av Robert Koch den 24 mars 1882 och för denna bedrift tilldelades han nobelpriset i fysiologi eller medicin 1905.[21] Koch trodde inte att det fanns ett samband mellan boskaps och människors tuberkulossmittor, vilket fördröjde upptäckten av smittad mjölk som en orsak till sjukdomen (smittad mjölk som orsak till tuberkulos minskade drastiskt efter genombrottet med pastöriseringsprocessen). Koch introducerade 1890 ett glycerinextrakt av tuberkelbakterien som ett sorts botemedel för sjukdomen och han benämnde det "tuberkulin". Extraktet visade sig inte vara ett fungerande botemedel, men användes istället med framgång inom screeningtest för att tidigt kunna upptäcka tuberkulossymtom hos en patient.[22]
År 1906 var Albert Calmette och Camille Guérin de första att uppnå riktiga framgångar med att immunisera mot tuberkelbakterien. De använde sig av en försvagad stam av M. bovis för att skapa vaccinet Bacillus Calmette-Guérin (BCG). Detta vaccin användes för första gången på människor 1921 i Frankrike,[23] men fick sitt stora genombrott i USA, Storbritannien och Tyskland först efter andra världskriget.[24]
Tuberkulos fick under 1800-talet och tidigt 1900-tal statusen som en endemisk sjukdom som spred sig bland de fattiga i städerna. Vart fjärde dödsfall i England 1815 var på grund av så kallad consumption, en gammal engelsk term för lungtuberkulos. Vart sjätte dödsfall i Frankrike 1918 var fortfarande orsakat av tuberkulos. Efter att det under 1880-talet hade fastställts att tuberkulos var en smittsam sjukdom påbörjades kampanjer i Storbritannien för att hindra folk från att spotta på offentliga platser. De fattiga som var smittade uppmanades att söka sig till sanatorier som till stor del påminde om fängelser (sanatorier för medel- och överklassen hade dock utmärkt service och erbjöd konstant medicinsk vård). I en undersökning från cirka 1916 visade det sig att hälften av de som skrivits in på sanatorium avled inom fem år.[20]
I Europa började tuberkulosfallen öka under 1600-talet och de nådde sin topp under 1800-talet, när närmare vart fjärde dödsfall var orsakat av sjukdomen.[25] Sjukdomens dödlighet hade minskat med nästan nittio procent under 1950-talet.[26] Folkhälsan genomgick ständiga förbättringar och sjukdomens dödlighet minskade redan innan streptomycin och andra typer av antibiotika hade introducerats (det vill säga före 1946). Dock var tuberkulos fortfarande ett stort hot mot allmänheten, vilket märktes när Medical Research Council grundades i Storbritannien 1913 (vars ursprungliga fokus var forskning om sjukdomen).[27] Det fanns under senare delen av 1900-talet ett hopp om att helt kunna utrota tuberkulos, men dessa förhoppningar grusade när fallen av antibiotikaresistens ökade under 1980-talet. Detta ledde till att tuberkulosfallen ännu en gång ökade och 1993 varnade Världshälsoorganisationen (WHO) för att tuberkulos kunde bli en global hälsorisk.[28]
Inom folktron
Före den industriella revolutionen kunde tuberkulos ibland betraktas som en form av vampyrism. När en medlem av en familj dog av sjukdomen hade andra i familjen redan smittats och tynade i sin tur sakta bort; folk trodde att detta berodde på att den ursprungligen sjuke sög ut livskraften från de andra. Dessutom fanns det likheter mellan tuberkulossymtom och traditionella vampyrattribut. Tuberkulosoffer har ofta röda svullna ögon (och är därför överkänsliga för ljus), blek hy, låg kroppsvärme, svagt hjärta och blodig hosta.[29] Enligt en annan folktro berodde tuberkulos på att man tvingades delta i älvors nattliga riter och att man därför tynade bort på grund av sömnbrist. Denna tro var vanligast där man såg en koppling mellan älvor och de döda. På samma sätt, men inte lika vanligt, troddes tuberkulos kunna bero på att häxor använde offren som riddjur på natten, vilket återigen ledde till sömnbrist.[30]
Tuberkulos romantiserades under 1800-talet. Många trodde att tuberkulos orsakade euforiska känslor som kallades "spes phthisica" eller "den tuberkulossjukes hopp". Man trodde att tuberkulossjuka som var artister fick utbrott av kreativitet allt eftersom sjukdomen fortskred och även att de sjuka fick en sista energikick strax innan de dog, en kick som gjorde kvinnor vackrare och män mer kreativa.[31] Under tidigt 1900-tal trodde en del människor att tuberkulos orsakades av onani.[32]
Historiska studier
Studier av tuberkulos kan härledas åtminstone till Avicenna på 1020-talet. Han var den förste läkaren som identifierade lungtuberkulos som en smittsam sjukdom, den förste att upptäcka kopplingen till diabetes och den förste att föreslå att tuberkulos kunde smitta genom kontakt med jord och vatten.[33][34] Avicenna utvecklade metoden med karantän för att begränsa spridningen av tuberkulos.[35] I antiken fokuserades behandlingen på de drabbades diet. Plinius den äldre beskrev flera metoder i sin Naturhistoria, däribland "varglever i tunt vin, späck från en sugga som har levt på gräs eller köttet från en åsninna i buljong".[36]
Symtom
Ungefär 5–15 procent av de som lider av tuberkulos, men inte av HIV, utvecklar en aktiv variant av tuberkulos under sina livstider.[7] I kontrast till detta utvecklar cirka 30 procent av de som redan är smittade av HIV en aktiv variant av tuberkulos under sina livstider.[37] Tuberkulos kan drabba alla kroppsdelar, men är oftast centrerad till lungorna (så kallad pulmonell tuberkulos eller lungtuberkulos). Extrapulmonell tuberkulos (det vill säga tuberkulos utanför lungorna) är normalt inte smittsam, men den kan samexistera med pulmonell tuberkulos som är smittsam.[38][39]
Pulmonell tuberkulos (lungtuberkulos)
Om sjukdomen blir aktiv kan upp mot 90 procent av fallen ske i lungorna; cirka 25 procent av den smittade befolkningen uppvisar inga som helst symtom (det vill säga de lider av en asymtomatisk latent infektion).[8] Symtomen inkluderar bröstsmärtor, blodstörtning och långvarig hosta i mer än tre veckor. Systemiska symtom är feber, frossa, nattliga svettningar, aptitförlust, viktförlust, blekhet, kraftlöshet och en tendens att lätt bli utmattad.[40] Även trumpinnefingrar kan drabba den som lider av tuberkulos.[37] I sällsynta fall kan infektionen drabba lungartären och resultera i ett massivt artärbråck. Tuberkulos kan utvecklas till en kronisk sjukdom och orsaka omfattande skador på lungornas övre lober; de övre loberna drabbas oftare av sjukdomen än de undre.[38] Anledningen till detta är inte helt klarlagt. Det kan bero på ett bättre luftflöde i de undre delarna av lungorna[5] eller på sämre dränering av lymfvätska i de övre delarna av lungorna.[38]
Extrapulmonell tuberkulos (tuberkulos utanför lungorna)
I cirka 15–20 procent av de aktiva fallen sätter sig infektionen någon annanstans än i lungorna och orsakar andra former av tuberkulos,[41] som tillsammans kallas för extrapulmonell tuberkulos. Detta inträffar oftare hos små barn och personer med försvagat immunsystem. Hos dem som tidigare lider av HIV och som sedan drabbas av tuberkulos får mer än 50 procent extrapulmonell tuberkulos.[42] Organ som ofta drabbas är centrala nervsystemet (meningit), lymfsystemet (halsskrofler), ben och leder (Potts sjukdom eller en form av osteomyelit) och könsorganen.[5] En särskilt allvarlig form av tuberkulos är miliartuberkulos, där sjukdomen sprids ut i kroppen via blodomloppet.[38] Cirka 10 procent av fallen av extrapulmonell tuberkulos är miliartuberkulos.[43]
Bakterier som orsakar tuberkulos

Den primära orsaken till tuberkulos, Mycobacterium tuberculosis, är en orörlig, aerob bakterie[38] som delar sig var 16–20 timme, vilket är en mycket långsam delningstakt jämfört med många andra bakterier som ofta delar sig en gång i timmen eller mer.[44] M. tuberculosis tillhör släktet mykobakterier och de har ett yttre membran som är uppbyggt av ett dubbelskikt av lipider.[45] Därför fungerar gramfärgning dåligt på M. tuberculosis, då den antingen bara färgas svagt eller inte håller kvar färgen (vilket beror på de lipider och den mykolsyra som cellen är uppbyggd av).[46] M. tuberculosis är en liten stavformad bacill som kan motstå svaga desinfektionsmedel och överleva som torra sporer i flera veckor. I naturen kan bakterien bara växa inuti celler, men det går att odla den i laboratorium.[47]
M. tuberculosis kan identifieras i mikroskop med hjälp av histologisk färgning av upphostat slem. Eftersom M. tuberculosis behåller vissa färgningar efter syrabehandling klassas den som en syrafast bakterie.[5][46] Den vanligaste syrafasta färgningstekniken (Ziehl–Neelsen) färgar M. tuberculosis klarröd, vilket gör att den tydligt syns mot en blå bakgrund.[48] Andra sätt att visualisera den inkluderar auramin-rhodamin-färgning och fluorescent mikroskopi.[49]

Andra mykobakterier som är nära besläktade med M. tuberculosis kan också orsaka tuberkulos.[50] Dessa inkluderar:
- M. africanum
- M. bovis
- M. canetti
- M. microti
M. africanum är inte särskilt utbredd över världen, men i delar av Afrika står den för en märkbar andel av tuberkulosfallen.[51][52] M. bovis är, som namnet anger, främst förknippad med tuberkulossmitta hos nötkreatur och var tidigare vanlig även hos människor via bland annat smittad mjölk. Dock innebar pastöriseringen av mjölk att den smittkällan mer eller mindre eliminerades, åtminstone i industriländerna.[5][53] M. canetti är ovanlig och verkar endast vara begränsad till Afrikas horn, även om enstaka fall har upptäckts hos afrikanska emigranter.[54] M. microti är även den ovanlig och påträffas mest hos människor med försvagat immunsystem, även om det är möjligt att dess förekomst har underskattats.[55]
Andra kända sjukdomsalstrande mykobakterier inkluderar M. leprae, M. avium och M. kansasii. Som namnet anger är M. leprae huvudorsaken till spetälska (även kallat lepra). De andra två andra mykobakterierna orsakar varken tuberkulos eller spetälska, men kan orsaka lungsjukdomar som påminner om tuberkulos.[56]
Evolution
Tuberkulos har en lång historia av samevolution med människan. Sjukdomen har definitivt förekommit hos människor i tusentals år, möjligtvis i miljoner år;[57] dock är de äldsta mänskliga fossilerna som visar spår av tuberkulos 9 000 år gamla.[12] Under den här utvecklingen har M. tuberculosis förlorat ett antal regioner i sitt genom, såväl kodande som icke-kodande DNA, och dessa förluster kan användas för att särskilja olika bakteriestammar. Olika stammar av M. tuberculosis förekommer i olika geografiska områden så de genetiska skillnaderna kan användas för att spåra ursprung och spridning av en bakteriestam.[58]
Smitta och riskgrupper
När en som lider av aktiv lungtuberkulos hostar, nyser, pratar eller spottar utslungas små smittsamma droppar (0,5-5 µm i diameter), där en enda nysning kan sprida upp till 40 000 av dessa droppar.[59] Varje droppe kan infektera en annan människa eftersom den dos som behövs för att starta en infektion är mycket liten; att andas in färre än tio bakterier kan räcka för att bli smittad.[60] Sjukdomen kan även spridas genom kött eller mjölk från infekterade kor.[5]
Personer med långvarig, ofta förekommande eller intim kontakt med smittbärare löper särskilt hög risk att bli smittade, upp till 22 procents risk.[61] En person med aktiv obehandlad tuberkulos kan smitta 5–15 andra personer om året.[7] Andra grupper som riskerar smitta är:[62]
- de som bor i områden där tuberkulos är vanligt förekommande
- sprutnarkomaner som injicerar under ohygieniska förhållanden
- de som bor eller arbetar under trånga förhållanden, med låga inkomster och med otillräcklig tillgång till sjukvård
- vissa minoritetsbefolkningar
- barn vars föräldrar tillhör högriskkategorier
- personer med nedsatt immunförsvar på grund av AIDS eller immunosuppressiva läkemedel
- personer som exponeras för kvarts i sitt arbete
- personer som genomgår långvarig kortikosteroidbehandling
- vårdpersonal som vårdar patienter i högriskkategorier
- personer som lider av cancer i huvud och/eller hals
- de med hematologiska och retikulo-endoteliala sjukdomar (såsom leukemi och Hodgkins lymfom)
- personer som lider av vissa njursjukdomar
- personer med brist på D-vitaminer[63]
- de som har låg kroppsvikt[5][39]
- personer som lider av malabsorption, näringsbrist,[8] dammlunga[64] eller diabetes[65] (personer som lider av diabetes svarar sämre på behandling på grund av sämre upptagning av medicin[66])
- alkoholister[8] och rökare[67]
Bara personer med aktiv tuberkulos är smittsamma, inte de som bär en latent infektion.[5] Sannolikheten för smitta beror på hur många smittsamma droppar den sjuke sprider omkring sig, hur bra ventilationen är, hur lång tid personen blir utsatt för smitta och hur smittsam den aktuella bakteriestammen är.[39] Smittkedjan kan därför brytas genom att isolera patienter med aktiv tuberkulos och ge dem effektiv antibiotikabehandling. Efter två veckors behandling är patienter normalt inte längre smittsamma, förutsatt att bakterierna inte är antibiotikaresistenta. Om en person blir smittad tar det som regel tre till fyra veckor innan denna i sin tur kan smitta andra.[68]
Tvillingstudier under 1940-talet visade på att mottagligheten för tuberkulos var ärftlig. Om en tvilling fick tuberkulos var risken större för den andra tvillingen, om de var enäggstvillingar än om de var tvåäggstvillingar.[69] Sedan dess har specifika genetiska polymorfismer i IL12B sammankopplats med tuberkulossusceptibilitet.[70] Vissa läkemedel, bland annat mediciner mot reumatoid artrit som verkar genom att blockera cytokinet tumörnekrosfaktor-alfa, ökar risken för att en latent infektion aktiveras beroende på den betydelse detta cytokin har för immunsystemet.[71]
I världen
Infektionsfrekvensen är mycket ojämnt fördelad globalt och år 2015 var 60% av alla kända fall i bara sex länder: Indien, Indonesien, Kina, Nigeria, Pakistan och Sydafrika. Samma år insjuknade 10,4 miljoner människor varav runt 20% hade chans till att få en antibiotikabehandling. Uppskattningsvis dödade sjukdomen cirka 1,4 miljoner människor under det året.[72]
Danmark
I Danmark registreras omkring 300-400 nya tuberkulosfall om året. Två tredjedelar är födda i länder med en hög utbredning av tuberkulos och många av dessa har smittats i sitt hemland.[73]
Finland
Finland hade på 1930-talet fortfarande över 8 000 dödsfall om året i tuberkulos, men kunde genom en världsledande tuberkulosbekämpning i stort sett lösa sjukdomsproblemet till början av 1970-talet. År 2018 hade antalet inträffade fall minskat till cirka 300 om året med få dödsfall och mer än hälften av fallen upptäcktes hos personer som invandrat.[74] På grund av den gynnsamma utvecklingen i Finland ges tuberkulosvaccin sedan 2006 bara till riskgrupper, till exempel barn som flyttar eller reser till ett tuberkulostätt område.[75][76] Motsvarande gäller för Sverige sedan 1975.[77][78]
Norge
År 2016 rapporterades 298 fall av tuberkulos varav 90% var födda utomlands.[79]
Sverige

Mot slutet av 1900-talet var tuberkulos nästan utrotad i Sverige, men efter globalisering, flyktingmottagande och invandring hade sjukdomen börjat öka igen under 2000-talets första årtionde. Ökningen utgjordes i första hand av individer som smittats före sin ankomst till Sverige. År 2007 rapporterades 497 nya fall av tuberkulos, varav enskilt största gruppen utgjordes av somalier. Ökningen fortsatte med 554 fall år 2008 och 643 fall år 2009 då fortsatt utlandsfödda från länder på Afrikas horn var överrepresenterade.[81]
De allra flesta som numer insjuknar i TBC i Sverige kommer från länder där TBC fortfarande är vanligt. De svenskar som insjuknar är företrädesvis äldre, över 60 år, och har sannolikt smittats i barndomen.[82] Under 2015 anmäldes 835 nya fall av tuberkulos i Sverige, vilket innebar en ökning med 22% jämfört med 2014.[83] Av de 835 fallen blev 97 smittade i Sverige.[83]
Under 2016 rapporterades 421 fall av Folkhälsomyndigheten från 1 januari till 30 juni, varav 48% var födda i Afrika, 25% födda i Asien (främst Afghanistan) och 10% var födda i Sverige. Av de 421 var 32% kvinnor eftersom könsfördelningen på invandringen dominerades av unga män och TBC drabbar främst yngre vuxna i länder med pågående epidemier.[84]
Tyskland
År 2014 rapporterade Robert Koch Institut att 4488 fall noterades, vilket motsvarade en frekvens på 5,6 fall per 100 000 invånare. Detta var 3,9% högre än föregående år och var i storleksordning liknande antalet för 2008-2009. Ökningen följde ökningarna från föregående åren 2012 och 2013 vilket indikerade att den långa trenden med sjunkande antal fall av TBC hade brutits. Frekvensen var högst i åldersgrupen 20-24 år med 9,6 fall per 100 0000. Frekvensen för utländska medborgare var 33,6 per 100 000, 13 gånger högre än för tyska medbogare (2,5 per 100 000) en diskrepans som var högre än föregående år.[85] Ökningen fortsatte åren 2015-2017.[72]
Andelen patienter födda utomlands ökade från föregående år, från 57,0% år 2013 till 62,4% år 2014. De vanligaste födelseländerna inkluderade Somalia, Turkiet och Rumänien. Det vanligaste födelselandet för patienter med multiresistent tuberkulos var länder i före detta Sovjetunionen.[85]
Diagnos

Aktiv smitta
Att diagnostisera en aktiv tuberkulossmitta baserat enbart på smittotecken och symtom är svårt,[86] likaså är det att diagnostisera dem som lider av immunsuppression. En diagnos bör dock göras på de personer som lider av någon sorts lungsjukdom som har pågått i mer än två veckor. Lungröntgen skall göras tillsammans med undersökningar av sputumodlingar för syrafasta baciller.[87] En definitiv diagnos av tuberkulos görs genom att identifiera M. tuberculosis i ett kliniskt prov (till exempel via sputum, var eller en biopsi). Det främsta problemet med att diagnostisera tuberkulos är att bakterien är mycket svårodlad och förökar sig långsamt; en sputumodling kan ta 2–6 veckor att odla fram i ett laboratorium.[88] En komplett tuberkulosundersökning måste inkludera en medicinsk historia, en fysisk undersökning, en lungröntgen och en bakterieodling. Ett Mantouxtest, uppkallat efter den franske läkaren Charles Mantoux,[89] kan även ingå; Mantouxtestet benämns även tuberkulinprov. Detta är ett serologiskt test som går till så att PPD (purified protein derivative) injiceras under huden. Om detta ger en immunreaktion har patienten antikroppar mot tuberkulos. Tolkningen av Mantouxtestet beror på patientens riskfaktorer och eventuella immunproblem samt på om patienten tidigare blivit vaccinerad mot tuberkulos med BCG-vaccin.[39] Även nukleinsyratest och adenosindeaminastest har visat sig kunna skynda på diagnosen av tuberkulos.[86]
Latent smitta
En latent smitta diagnostiseras för närvarande hos icke-vaccinerade personer genom Mantouxtestet, som då ger upphov till en fördröjd hypersensitivitetsreaktion.[5] De som är vaccinerade eller tidigare blivit botade från tuberkulos reagerar dock på samma sätt som infekterade, varför testet måste tolkas med försiktighet särskilt vad gäller personer från länder där vaccination är vanligt.[90] Mantouxtestet kan alltså producera falska positiva svar hos botade och vaccinerade personer, men även falska negativa svar förekommer särskilt om patienten samtidigt lider av både tuberkulos och Hodgkins lymfom, sarkoidos eller undernäring.[5] Nya typer av tuberkulintest håller på att utvecklas med förhoppningen att man ska få fram test som är billigare, snabbare och pålitligare. De inkluderar PCR-detektion av bakterie-DNA och tester som mäter det gammainterferon som utsöndras som svar på mykobakterieproteiner såsom ESAT-6.[91] Dessa test reagerar inte på vaccinerade personer och inte heller på mykobakterier i den omgivande miljön, så de förväntas ge färre falska positiva prover.[92] Utvecklingen av snabba och billiga test skulle vara särskilt värdefulla i utvecklingsländer.[93]
Sjukdomsförlopp

Omkring 90 procent av de som infekterats med M. tuberculosis får en asymtomatisk latent tuberkulossmitta med bara 10 procent sannolikhet att den latenta infektionen utvecklas till aktiv tuberkulossjukdom.[5] Dock är dödligheten mer än 50 procent för dessa aktiva tuberkulosfall om de inte behandlas.[94]
En tuberkulossmitta påbörjas när bakterien når lungblåsorna, där den invaderar och förökar sig inuti endosomerna hos alveolära makrofager.[5][95] Den primära smittopunkten i lungorna kallas "Ghon-fokus" och ligger vanligtvis antingen i den övre delen av den nedre lungloben eller i den nedre delen av den övre lungloben.[5] Bakterierna fångas upp av dendritiska celler som inte tillåter dem att föröka sig, även om dessa celler kan transportera bakterierna till de lokala mediastinala lymfnoderna. Därifrån kan bakterierna sprida sig genom blodomloppet vidare till andra vävnader och organ där sekundära infektioner kan utvecklas, vilket kallas för "Simon-fokus".[96] Vanliga platser för sekundärsmitta är andra delar av lungorna särskilt toppen av övre lungloben, perifera lymfnoder, njurar, hjärna och skelett.[5][97] Alla organ i kroppen kan drabbas av sjukdomen, men sällan hjärtat, muskler, bukspottkörteln och sköldkörteln.[98]
Tuberkulos klassas som ett granulomatöst inflammatoriskt tillstånd. Makrofager, T-celler, B-celler och fibroblaster är bland de celler som samlas för att skapa ett granulom, där lymfocyterna omringar de infekterade makrofagerna. Granulomet inte bara hindrar bakterierna från att spridas utan det tillhandahåller också en miljö där immunsystemets celler kan kommunicera. Inom granulomet utsöndrar T-celler (CD4+) cytokiner såsom gammainterferon, vilket aktiverar makrofager som förstör bakterierna som de är infekterade med.[99] T-celler (CD8+) kan också direkt döda smittade celler.[95] Det är viktigt att notera att bakterierna inte alltid elimineras i ett granulom. De kan istället komma in i ett vilande tillstånd, vilket resulterar i en latent smitta.[5] Ett annat kännetecken på granulom i tuberkulos är celldöd inuti tuberklerna. För blotta ögat ser det döda materialet ut som mjuk vit ost, vilket beskrivs med termen kaseös nekros.[100] Om tuberkulosbakterier kommer ut i blodomloppet från den skadade vävnaden kan de sprida sig i kroppen och starta nya infektioner på många ställen, som alla visar sig som små vita tuberkler i vävnaden. Detta är en mycket allvarlig form av sjukdomen som kallas för miliartuberkulos. Patienter med den här utbredda formen av tuberkulos har en dödlighet på 20 procent även med intensiv behandling.[101]
Hos många patienter kan sjukdomen gå fram och tillbaka, så att läkande och fibros balanserar vävnadsskador och celldöd.[100] Den infekterade vävnaden ersätts av ärrvävnad och hålrum fyllda med det vita ostliknande nekrotiska materialet. När sjukdomen är aktiv öppnas en del av dessa hålrum mot luftkanalerna i lungorna, vilket gör att materialet kan hostas upp. Det innehåller levande bakterier och kan därför smitta omgivningen. Behandling med lämpliga antibiotika dödar bakterierna och låter vävnaden läkas, men även när sjukdomen är helt botad finns det fortfarande ärrvävnad kvar i de drabbade områdena.[100]
Progression från latent infektion till aktiv tuberkulossjukdom inträffar när bakterierna övervinner immunsystemets försvar och börjar föröka sig. Vid primär tuberkulos (cirka 1–5 procent av fallen) händer detta bara en kort tid efter att en person smittats.[5] I en majoritet av fallen leder dock smittan först till en latent infektion utan uppenbara symtom.[5] Latent tuberkulos utvecklas till aktiv sjukdom i 2–23 procent av fallen, ofta många år efter smittotillfället.[102] Risken för reaktivering av latent tuberkulos ökar vid svagheter i immunsystemet till exempel hos HIV-positiva. Saminfektion mellan tuberkulos och HIV ökar risken att tuberkulosen aktiveras till 10 procent per år.[5][94]
Behandling
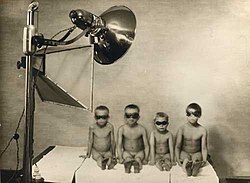

Sanatorievård

Länge behandlades tuberkulos på särskilda sjukhus, sanatorier. Behandlingen bestod av den klassiska "hygienisk-dietetiska" sanatoriekuren, utarbetad av tyskarna Hermann Brehmer och Peter Dettweiler, och denna behandling ansågs öka den naturliga resistensen mot sjukdomen. I kuren ingick vila, frisk luft och näringsriktig mat.[103] Sanatorierna försvann i mitten av 1900-talet, då de första effektiva läkemedlen (streptomycin och paraaminosalicylsyra, PAS) hade lanserats. Dessutom minskade insjuknandefrekvensen i tuberkulos tack vare BCG-vaccinet.
Kirurgisk behandling
Det är ovanligt att kirurgisk behandling tillgrips under 2000-talet eftersom den inte botar sjukdomen utan enbart i bästa fall kan dämpa sjukdomens vidare progress. Förr var det kollapsterapi som utfördes medan det numer är resektion av del av lunga som angripits.
"Kollapsterapi"
Kollapsterapi har närmast historiskt intresse som förr utfördes. "Kollapsterapi" (gassprängning av lungtrakten) som gick till på så sätt att man först lossade lungan genom en operation, sedan stack man in en tjock nål mellan revbenen och gasade området där lungan normalt skulle ligga för att trycka ned den, vilket gjordes cirka en gång i månaden under flera års tid. På detta sätt sattes lungan "ur bruk" och såren i den fick tid att läka. Kollapsterapi leder dock till livslång och kraftigt nedsatt lungfunktion och behandlingen utförs mycket sällan i dag och då vid sjukdom med bakterier som har komplexa resistensmönster, då den till skillnad från antibiotika inte botar sjukdomen utan bara lindrar förloppet.[104]
Resektion
Resektion av en del av angripen lunga är en ovanlig åtgärd som kan tillgripas när kemoterapi är otillfredsställande på grund av framför allt multiresistens.
Kemoterapi
Tuberkulos behandlas i första hand med antibiotika för att döda bakterierna och de två antibiotika som används mest är rifampicin och isoniazid. Resistensutveckling har medfört ökande svårigheter att bota sjukdomen hos smittade personer och WHO har publicerat särskilda behandlingsanvisningar för resistenta bakteriestammar[105]. Mot andra sjukdomar brukar en kort antibiotikakur räcka, men vid tuberkulos krävs en mycket längre behandling (6–12 månaders kontinuerlig antibiotikabehandling) för att helt eliminera bakterierna ur kroppen.[39] Behandling av latent tuberkulos använder vanligtvis bara en sorts antibiotikum medan aktiv tuberkulos bäst behandlas med en kombination av flera (ofta tre-fyra) sorter för att minska risken att bakterierna utvecklar resistens.[106] Människor med latent tuberkulos behandlas för att hindra att sjukdomen blir aktiv senare i livet. En behandling med rifampicin och pyrazinamid är dock inte ofarlig. Det amerikanska smittskyddsinstitutet Centers for Disease Control and Prevention (CDC) ändrade 2003 sina rekommendationer beträffande behandling av latent tuberkulos, på grund av allvarliga leverskador som alltför vanliga biverkningar av behandlingen.[107]
Antibiotikaresistens är ett vanligt problem vid tuberkulosbehandling och resistenta bakterier sprids på samma sätt som vanliga tuberkulosbakterier. När en människa infekteras med redan resistenta bakterier kallas detta primär resistens. Hos en människa som smittats med normalt antibiotikakänsliga bakterier kan istället sekundär resistens utvecklas under antibiotikabehandling, särskilt om behandlingen inte genomförs fullt ut. Luckor och avbrott i den långvariga behandlingen eller mediciner med låg kvalitet underlättar resistensutveckling.[106] Det är därför mycket viktigt vid all antibiotikabehandling att nogsamt genomföra hela den föreskrivna behandlingen även om patienten redan känner sig frisk. Detta är ett extra svårt problem för tuberkulos eftersom behandlingen är så långvarig och kräver en kombination av flera dyra mediciner och för att patienten kan vara omotiverad eftersom denne redan känner sig frisk ganska snart efter att behandling påbörjats. I tredje världen är antibiotikaresistent tuberkulos ett allvarligt folkhälsoproblem eftersom tuberkulos är vanligt förekommande och många fattiga inte har råd att ta de dyra medicinerna månader i sträck. Multiresistent tuberkulos definieras som resistens mot de två mest effektiva medicinerna mot ickeresistent tuberkulos: rifampicin och isoniazid. Det finns sex typer av "reservmediciner" att använda mot multiresistent tuberkulos, men vissa tuberkulosvarianter kan vara resistenta mot tre eller fler av dessa.[108] En av anledningarna till en kraftig ökning av multiresistent tuberkulos i vissa länder är att läkemedel mot denna smitta är receptfri och därför lättillgänglig.[109]
Prevention
Förebyggande och kontroll av tuberkulos sker längs två parallella spår: för det första ska tuberkulospatienternas kontakter identifieras och behandlas, särskilt de som tillhör högriskgrupper, och för det andra ska barn vaccineras för att skydda dem från sjukdomen. I tropiska områden är dock andra arter av mykobakterierna ganska vanliga. Dessa orsakar normalt inte tuberkulos, men kan ändå stimulera en persons immunförsvar till att utveckla viss motståndskraft mot sjukdomen.[110] Eftersom människan är det enda värddjuret för M. tuberculosis skulle denna bakterie i princip vara möjlig att utrota, liksom hur smittkopporna utrotades, vilket skulle underlättas enormt av ett effektivt vaccin.[111] Världshälsoorganisationen (WHO) förklarade tuberkulos för en global hälsofara 1993 och organisationen Stop TB Partnership utvecklade en global plan för att stoppa tuberkulos, där målet var att rädda 14 miljoner liv mellan 2006 och 2015;[112] ett mål som var svårt att nå på grund av ökningen av både HIV-associerad och multiresistent tuberkulos.[8]
Vacciner
Många länder använder BCG-vaccinet som ett led i sin tuberkuloskontrollstrategi, då särskilt för barn. Enligt Världshälsoorganisationen är detta det mest använda vaccinet i världen, med 85 procent av barnen i 172 länder vaccinerade 1993.[114] BCG, uppkallat efter Albert Calmette och Camille Guérin, var det första tuberkulosvaccinet och det utvecklades vid Pasteurinstitutet i Frankrike 1905–1921.[23] Massvaccinering av barn påbörjades dock inte förrän efter andra världskriget.[24] BCG-vaccinet ger skydd mot allvarliga former av tuberkulos hos barn, till exempel hjärnhinneinflammation, medan skyddet mot lungtuberkulos hos vuxna är mycket varierande (från 0–80 procent).[115] I Sydafrika, det land som har den högsta förekomsten av tuberkulos i världen, ges BCG-vaccin till alla barn före tre års ålder.[116] BCG är dock inte lika effektivt i områden där mykobakterier inte är så vanliga och därför vaccineras inte alltid hela befolkningen i sådana länder. Den allmänna vaccinationen av alla barn i Sverige upphörde 1975 och nu erbjuds vaccination bara till den som tillhör särskilda riskgrupper.[117]
På grund av det varierande skyddet och det höga antalet tuberkulossmittade är det angeläget att ett nytt och mer effektivt vaccin utvecklas.[118] Flera nya vacciner mot tuberkulos är därför under utveckling. Det första vaccinet som bygger på rekombinant DNA-teknik, rBCG30, genomgick klinisk prövning i USA 2004[119] och i november 2008 var fas I avklarad för vaccinet.[120] En studie från 2005 visade att ett DNA-vaccin som gavs tillsammans med vanlig antibiotikabehandling påskyndar tillfrisknandet och skyddar mot återinfektion hos möss, något som då skulle kunna bli tillgängligt för människor om fyra eller fem år.[121] Ett mycket lovande vaccin (MVA85A) baserat på genetiskt modifierade vacciniavirus, befann sig 2006 i klinisk prövning fas II i Sydafrika[122] och under 2010 framkom det att några riktiga resultat av vaccinet inte var att vänta förrän tidigast 2015.[123] Ett bakslag kom dock i februari 2013 när resultaten av vissa test av MVA85A visade sig vara "nedslående".[124] Många andra strategier prövas också för att utveckla nya vacciner,[125] däribland både subenhetsvacciner (molekyler sammansatta av två rekombinanta proteiner som levereras i en adjuvant), såsom Hybrid-1, HyVac4 och M72, och rekombinanta adenovirus såsom Ad35.[126][127][128][129] Vissa av dessa vaccin kan effektivt ges utan nålar, vilket gör dem mer attraktiva i områden där HIV är vanligt.[130] Alla dessa vaccin har framgångsrikt testats hos människor och undergår nu vidare prövning i områden med endemisk tuberkulos. För att uppmuntra fortsatt vaccinforskning studeras nya modeller för finansiering av vaccinutveckling med priser, skatteincitament och förhandsbeställningar.[131][132] Bill & Melinda Gates Foundation har varit en framträdande förkämpe för utvecklingen av nya tuberkulosvaccin. De tillkännagav 2007 ett bidrag på $200 000 000 för klinisk prövning av upp till sex olika tuberkulosvaccin som är under utveckling.[133]
Vaccinering i Sverige
I Sverige var vaccinering med BCG-vaccin tidigare allmänt rekommenderad, men sedan 1975 rekommenderas endast riskgrupper att vaccinera sig. Risken att en frisk person med svensk bakgrund ska smittas i Sverige är liten, så liten att det inte är motiverat att vaccinera sådana personer. De som fortfarande rekommenderas att vaccinera sig är barn och vuxna med bakgrund i länder där tuberkulos fortfarande är vanligt förekommande. 2013 var cirka en fjärdedel av barnen födda 2010 vaccinerade innan två års ålder.[82]
Epidemiologi
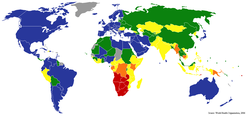

Enligt Världshälsoorganisationen är en fjärdedel av världens befolkning bärare av tuberkulossmitta.[7] Årligen insjuknar tio miljoner människor i tuberkulos och 1,5 miljoner dör av sjukdomen i världen.[7] År 2004 hade omkring 14,6 miljoner människor aktiv tuberkulos, med nio miljoner nya fall. Incidenstalet varierar från 356 per 100 000 i Afrika till 41 per 100 000 i Amerika.[40] Tuberkulos är den smittsamma sjukdom som dödar flest kvinnor i reproduktiv ålder och är den ledande dödsorsaken bland människor med HIV/AIDS.[136] Ökningen av antalet HIV-smittade och försummelsen av tuberkuloskontrollprogram, vaccination av nyfödda inte längre rutin i många länder, har fått tuberkulos att åter öka kraftigt efter årtionden av nedgång.[137] Uppkomsten av antibiotikaresistenta stammar av bakterierna har också bidragit till denna nya tuberkulosepidemi, med 20 procent av fallen resistenta mot standardbehandling och två procent resistenta även mot reservmediciner.[108] Incidenstalen för tuberkulos varierar stort över världen, ibland även mellan grannländer, uppenbarligen på grund av skillnader i hälso- och sjukvårdssystem.[138]
År 2005 var Swaziland det land som hade högsta incidenstalet för tuberkulos, med 1 262 fall per 100 000 invånare. Indien har det största antalet fall i absoluta tal, med över 1,8 miljoner sjuka.[139] I i-länder är tuberkulos mindre vanligt och är då huvudsakligen ett storstadsfenomen. I Storbritannien varierar incidensen från 40 per 100 000 i London till mindre än fem per 100 000 på sydvästra Englands landsbygd;[140] det nationella genomsnittet är 13 per 100 000. De högsta talen i Västeuropa är i Portugal (31,1 fall per 100 000 år 2005) och Spanien (20 fall per 100 000). Det här kan jämföras med 113 per 100 000 i Kina och 64 per 100 000 i Brasilien. I USA var motsvarande siffra 4,9 per 100 000 år 2004.[141] I Kanada är tuberkulos fortfarande endemiskt i delar av Manitoba.[142] I både Sverige och Finland låg incidenstalet på 6 per 100 000 år 2005.[139] Tuberkulosförekomsten varierar med ålder. I Afrika drabbar tuberkulos främst ungdomar och unga vuxna.[143] I länder där tuberkulos har bringats under kontroll på senare år, såsom USA, är tuberkulos däremot främst en sjukdom hos äldre eller personer med nedsatt immunförsvar.[5][144]
Det finns ett antal kända faktorer som gör människor mer mottagliga för tuberkulossmitta och den viktigaste av dessa är HIV. Saminfektion med tuberkulos och HIV är särskilt ett problem i subsahariska Afrika, på grund av den mycket höga HIV-förekomsten där.[134][145] Att röka mer än 20 cigaretter om dagen ökar också risken för tuberkulos med två till fyra gånger.[146][147] Diabetes är även det en viktig riskfaktor som ökar i betydelsen i utvecklingsländerna.[65] Andra sjukdomar som ökar tuberkulosrisken är Hodgkins lymfom, kroniska njur- och lungsjukdomar, undernäring samt alkoholism.[5] Alkohol- och drogmissbruk är den vanligaste rapporterade faktorn till tuberkulos i USA.[148]
Diet är också en faktor som kan påverka tuberkulosrisken. Till exempel bland indiska invandrare i London befanns hinduer med vegetarisk kost ha en 8,5 gånger ökad risk jämfört med muslimer som åt kött och fisk dagligen.[149] Även om ett orsakssamband inte är bevisat[150] kan den ökade risken tänkas vara orsakad av brist på spårämnen, möjligen järn, B12-vitaminer eller D-vitaminer;[149] vidare studier har givit mer belägg för ett samband mellan D-vitaminbrist och tuberkulosrisk.[63][151] Globalt bidrar den allvarliga undernäringen i många utvecklingsländer till en kraftigt ökad risk att utveckla aktiv tuberkulos på grund av att undernäringen försvagar immunsystemet.[152][153] Tillsammans med trångboddhet kan undernäring bidra till det starka samband mellan tuberkulos och fattigdom som observerats.[154][155]
Se även
Referenser
Kommentarer
Noter
- ^ Svenska Akademiens ordbok: Lungsot
- ^ ”Sjukdomsinformation om tuberkulos (TBC)”. Smittskyddsinstitutet. Arkiverad från originalet den 3 januari 2012. https://web.archive.org/web/20120103223415/http://www.smittskyddsinstitutet.se/sjukdomar/tuberkulos. Läst 25 februari 2013.
- ^ ”Tuberkulos – tbc”. 1177 Vårdguiden. 13 mars 2019. https://www.1177.se/sjukdomar--besvar/lungor-och-luftvagar/inflammation-och-infektion-ilungor-och-luftror/tuberkulos--tbc/. Läst 1 december 2019.
- ^ ”Sjukdomsinformation om tuberkulos (TB)”. Folkhälsomyndigheten. 21 mars 2019. https://www.folkhalsomyndigheten.se/smittskydd-beredskap/smittsamma-sjukdomar/tuberkulos-tbc/. Läst 1 december 2019.
- ^ [a b c d e f g h i j k l m n o p q r s t u] Kumar et al. 2007, s. 516–522.
- ^ Carow, Berit; Hauling, Thomas; Qian, Xiaoyan; Kramnik, Igor; Nilsson, Mats; Rottenberg, Martin E. (2019-04-23). ”Spatial and temporal localization of immune transcripts defines hallmarks and diversity in the tuberculosis granuloma” (på engelska). Nature Communications 10 (1): sid. 1823. doi:. ISSN 2041-1723. https://www.nature.com/articles/s41467-019-09816-4. Läst 10 mars 2025.
- ^ [a b c d e] ”Tuberculosis” (på engelska). Världshälsoorganisationen (WHO). 17 oktober 2019. https://www.who.int/en/news-room/fact-sheets/detail/tuberculosis. Läst 1 december 2019.
- ^ [a b c d e] Lawn, S. D.; Zumla, A. I. (2 juli 2011). ”Tuberculosis”. Lancet "378" (9785): ss. 57–72. doi:. PMID 21420161.
- ^ Rothschild, B.; Martin, L.; Lev, G.; Bercovier, H.; Bar-Gal, G.; Greenblatt, C.; Donoghue, H.; Spigelman, M.; Brittain, D. (9 april 2001). ”Mycobacterium tuberculosis complex DNA from an extinct bison dated 17,000 years before the present”. Clin Infect Dis "33" (3): ss. 305–311. doi:. PMID 11438894.
- ^ Pearce-Duvet, J. (9 april 2006). ”The origin of human pathogens: Evaluating the role of agriculture and domestic animals in the evolution of human disease”. Biol Rev Camb Philos Soc "81" (3): ss. 369–382. doi:. PMID 16672105.
- ^ Ernst, J. D.; Trevejo-Nuñez, G.; Banaiee, N. (juli 2007). ”Genomics and the evolution, pathogenesis, and diagnosis of tuberculosis”. J. Clin. Invest. "117" (7): ss. 1738–1745. doi:. PMID 17607348.
- ^ [a b] Hershkovitz, I.; Donoghue, H. D.; Minnikin, D. E.; Besra, G. S.; Lee, OY-C; Gernaey, Angela M.; Galili, Ehud; Eshed, Vered; Greenblatt, Charles L.; Lemma, Eshetu; Bar-Gal, Gila Kahila; Spigelman, Mark (15 oktober 2008). ”Detection and Molecular Characterization of 9000-Year-Old Mycobacterium tuberculosis from a Neolithic Settlement in the Eastern Mediterranean.”. PLoS ONE "3" (10): s. e3426. doi:.
- ^ Zink, A.; Sola, C.; Reischl, U.; Grabner, W.; Rastogi, N.; Wolf, H.; Nerlich, A. (9 april 2003). ”Characterization of Mycobacterium tuberculosis complex DNAs from Egyptian mummies by spoligotyping”. J Clin Microbiol "41" (1): ss. 359–367. doi:. PMID 12517873.
- ^ Hippocrates (9 april 2000). ”Aphorisms” (på engelska). The Internet Classics Archive. Arkiverad från originalet den 11 februari 2005. https://web.archive.org/web/20050211173218/http://classics.mit.edu/Hippocrates/aphorisms.mb.txt. Läst 7 oktober 2006.
- ^ Konomi, N.; Lebwohl, E.; Mowbray, K.; Tattersall, I.; Zhang, D. (9 april 2002). ”Detection of mycobacterial DNA in Andean mummies”. J Clin Microbiol "40" (12): ss. 4738–4740. doi:. PMID 12454182.
- ^ ”SOUTH AMERICA: PREHISTORIC FINDINGS” (på engelska). Memórias do Instituto Oswaldo Cruz. januari 2003. Arkiverad från originalet den 29 september 2011. https://web.archive.org/web/20110929132315/http://memorias.ioc.fiocruz.br/98sup/6psa.html. Läst 8 februari 2007.
- ^ Trail, R. R. (1 april 1970). ”Richard Morton (1637-1698)”. Med Hist "14" (2): ss. 166–174. doi:. PMID 4914685. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC1034037/.
- ^ Zur Pathogenie der Impetigines. Auszug aus einer brieflichen Mitteilung an den Herausgeber. [Müller's] Archiv für Anatomie, Physiologie und wissenschaftliche Medicin. 1839, s. 82.
- ^ ”Kentucky: Mammoth Cave long on history” (på engelska). CNN. 27 februari 2004. Arkiverad från originalet den 13 augusti 2006. https://web.archive.org/web/20060813140746/http://edition.cnn.com/2004/TRAVEL/DESTINATIONS/02/26/mammoth.cave.ap/index.html. Läst 12 augusti 2013.
- ^ [a b] McCarthy, O. R. (1 augusti 2001). ”Arkiverade kopian”. J R Soc Med "94" (8): ss. 413–417. PMID 11461990. Arkiverad från originalet den 3 augusti 2012. https://archive.today/20120803180504/http://www.jrsm.org/cgi/pmidlookup?view=long&pmid=11461990. Läst 12 augusti 2013.
- ^ ”The Nobel Prize in Physiology or Medicine 1905” (på engelska). Nobelprize.org. https://www.nobelprize.org/prizes/medicine/1905/. Läst 12 augusti 2013.
- ^ Waddington, K. (januari 2004). ”To stamp out "So Terrible a Malady": Bovine tuberculosis and tuberculin testing in Britain, 1890–1939”. Med Hist "48" (1): ss. 29–48. doi:. PMID 14968644. http://www.ncbi.nlm.nih.gov/pmc/articles/PMC546294/.
- ^ [a b] Bonah, C. (9 april 2005). ”The 'experimental stable' of the BCG vaccine: Safety, efficacy, proof, and standards, 1921–1933”. Stud Hist Philos Biol Biomed Sci "36" (4): ss. 696–721. doi:. PMID 16337557.
- ^ [a b] Comstock, G. (9 april 1994). ”The International Tuberculosis Campaign: A pioneering venture in mass vaccination and research”. Clin Infect Dis "19" (3): ss. 528–540. PMID 7811874.
- ^ Bloom 1994, passim.
- ^ Persson 2010, s. 141.
- ^ Hannaway 2008, s. 233.
- ^ ”Frequently asked questions about TB and HIV” (på engelska). Världshälsoorganisationen (WHO). Arkiverad från originalet den 20 november 2011. https://web.archive.org/web/20111120235928/http://www.who.int/tb/hiv/faq/en/index.html. Läst 12 augusti 2013.
- ^ Sledzik, P.; Bellantoni, N. (9 april 1994). ”Brief communication: Bioarcheological and biocultural evidence for the New England vampire folk belief”. Am J Phys Anthropol "94" (2): ss. 269–274. doi:. PMID 8085617. http://www.ncbi.nlm.nih.gov/pubmed/8085617.
- ^ Briggs 1976, s. 80.
- ^ Lawlor, Clark (hösten 2003). "Transatlantic Consumptions: Disease, Fame and Literary Nationalism in the Davidson Sisters, Southey, and Poe". Studies in the Literary Imagination. Tillgänglig på findarticles.com. Läst 8 juni 2007. Arkiverad 15 oktober 2008 hämtat från the Wayback Machine.
- ^ Laumann et al. 1994, s. 80.
- ^ Al-Sharrah, Y. A. (2003). "The Arab Tradition of Medical Education and its Relationship with the European Tradition", Prospects 33 (4), Springer.
- ^ Sarton, George, Introduction to the History of Science. (cf. Dr. Zahoor, A. och Dr. Haq, Z. (1997). Quotations From Famous Historians of Science. Cyberistan)
- ^ Tschanz, David W. (augusti 2003). "Arab Roots of European Medicine", Heart Views 4 (2).
- ^ Plinius den äldre (Naturhistoria). Citerad i Naphtali, Lewis; Meyer, Reinhold. ”Roman Civilization”. http://books.google.com/books?id=GO8tcTpgj-0C.
- ^ [a b] Gibson et al. 2005, s. 321.
- ^ [a b c d e] Mandell, Bennett & Dolin 2010, kapitel 250.
- ^ [a b c d e] ”Core Curriculum on Tuberculosis” (på engelska). Centers for Disease Control and Prevention (CDC), Division of Tuberculosis Elimination. 9 april 2000. Arkiverad från originalet den 11 december 2003. https://web.archive.org/web/20031211204609/http://www.cdc.gov/nchstp/tb/pubs/corecurr/default.htm. Läst 9 augusti 2013.
- ^ [a b] ”Fact sheet N°104: Tuberculosis” (på engelska). World Health Organization (WHO). Mars 2006. Arkiverad från originalet den 4 oktober 2006. https://web.archive.org/web/20061004013508/http://www.who.int/mediacentre/factsheets/fs104/en/index.html. Läst 6 oktober 2006.
- ^ Jindal et al. 2011, s. 549.
- ^ Golden, Marjorie P.; Holenarasipur, R. Vikram (1 november 2005). ”Extrapulmonary Tuberculosis: An Overview”. Am Fam Physician "72" (9): ss. 1761–1768. http://www.aafp.org/afp/2005/1101/p1761.html.
- ^ Ghosh & Habermann 2008, s. 789.
- ^ Cox, R. (9 april 2004). ”Quantitative relationships for specific growth rates and macromolecular compositions of Mycobacterium tuberculosis, Streptomyces coelicolor A3(2) and Escherichia coli B/r: An integrative theoretical approach”. Microbiology "150" (5): ss. 1413–1426. doi:. PMID 15133103. http://mic.sgmjournals.org/cgi/content/full/150/5/1413?view=long&pmid=15133103#R35.
- ^ Niederweis, M.; Danilchanka, O.; Huff, J.; Hoffmann, C.; Engelhardt, H. (mars 2010). ”Mycobacterial outer membranes: In search of proteins”. Trends in Microbiology "18" (3): ss. 109–116. doi:. PMID 20060722.
- ^ [a b] Madison, B. (9 april 2001). ”Application of stains in clinical microbiology”. Biotech Histochem "76" (3): ss. 119–125. doi:. PMID 11475314.
- ^ Parish, T.; Stoker, N. (9 april 1999). ”Mycobacteria: Bugs and bugbears (two steps forward and one step back)”. Mol Biotechnol "13" (3): ss. 191–200. doi:. PMID 10934532.
- ^ Ochei & Kolhatkar 2000, s. 473.
- ^ Semba, Bloem & Piot 2008, s. 291.
- ^ van Soolingen, D.; Hoogenboezem, T.; de Haas, P. E.; Hermans, P. W.; Koedam, M. A.; Teppema, K. S.; Brennan, P. J.; Besra, G. S.; Portaels, F.; Top, J.; Schouls, L. M.; van Embden, J. D. (9 april 1997). ”A novel pathogenic taxon of the Mycobacterium tuberculosis complex, Canetti: Characterization of an exceptional isolate from Africa”. International Journal of Systematic Bacteriology "47" (4): ss. 1236–1245. doi:. PMID 9336935.
- ^ Niemann, S.; Rüsch-Gerdes, S.; Joloba, M. L.; Whalen, C. C.; Guwatudde, D.; Ellner, J. J.; Eisenach, K.; Fumokong, N.; Johnson, J. L.; Aisu, T.; Mugerwa, R. D.; Okwera, A.; Schwander, S. K. (1 september 2002). ”Mycobacterium africanum subtype II is associated with two distinct genotypes and is a major cause of human tuberculosis in Kampala, Uganda”. J. Clin. Microbiol. "40" (9): ss. 3398–3405. doi:. PMID 12202584. PMC: 130701. https://journals.asm.org/doi/epub/10.1128/JCM.40.9.3398-3405.2002.
- ^ Niobe-Eyangoh, S. N.; Kuaban, C.; Sorlin, P.; Cunin, Patrick; Thonnon, Jocelyn; Sola, Christophe; Rastogi, Nalin; Vincent, Veronique; Gutierrez, M. Cristina (juni 2003). ”Genetic biodiversity of Mycobacterium tuberculosis complex strains from patients with pulmonary tuberculosis in Cameroon”. J. Clin. Microbiol. "41" (6): ss. 2547–2553. doi:. PMID 12791879. PMC: 156567. https://journals.asm.org/doi/epub/10.1128/JCM.41.6.2547-2553.2003.
- ^ Thoen, C.; Lobue, P.; de Kantor, I. (februari 2006). ”The importance of Mycobacterium bovis as a zoonosis”. Vet. Microbiol. "112" (2-4): ss. 339–345. doi:. PMID 16387455.
- ^ Pfyffer, G. E.; Auckenthaler, R.; van Embden, J. D.; van Soolingen, D. (oktober-december 1998). ”Mycobacterium canettii, the smooth variant of M. tuberculosis, isolated from a Swiss patient exposed in Africa”. Emerging Infectious Diseases "4" (4): ss. 631–634. doi:. PMID 9866740.
- ^ Niemann, S.; Richter, E.; Dalügge-Tamm, H.; Schlesinger, H.; Graupner, D.; Königstein, B.; Gurath, G.; Greinert, U.; Rüsch-Gerdes, S. (9 april 2000). ”Two cases of Mycobacterium microti derived tuberculosis in HIV-negative immunocompetent patients”. Emerg Infect Dis "6" (5): ss. 539–542. PMID 10998387.
- ^ ”Diagnosis and treatment of disease caused by nontuberculous mycobacteria. This official statement of the American Thoracic Society was approved by the Board of Directors, March 1997. Medical Section of the American Lung Association”. Am J Respir Crit Care Med "156" (2): ss. S1–25. 9 april 1997. PMID 9279284.
- ^ Gutierrez, M. C.; Brisse, S.; Brosch, R.; Fabre, Michel; Omaïs, Bahia; Marmiesse, Magali; Supply, Philip; Vincent, Veronique (1 september 2005). ”Ancient origin and gene mosaicism of the progenitor of Mycobacterium tuberculosis”. PLoS Pathog. "1" (1): s. e5. doi:. PMID 16201017. PMC: 1238740. http://www.plospathogens.org/article/info:doi/10.1371/journal.ppat.0010005.
- ^ Rao, K.; Kauser, F.; Srinivas, S.; Zanetti, S.; Sechi, L.; Ahmed, N.; Hasnain, S. (9 april 2005). ”Analysis of genomic downsizing on the basis of region-of-difference polymorphism profiling of Mycobacterium tuberculosis patient isolates reveals geographic partitioning”. J Clin Microbiol "43" (12): ss. 5978–5982. doi:. PMID 16333085.
- ^ Cole, E.; Cook, C. (9 april 1998). ”Characterization of infectious aerosols in health care facilities: An aid to effective engineering controls and preventive strategies”. Am J Infect Control "26" (4): ss. 453–464. doi:. PMID 9721404.
- ^ Nicas, M.; Nazaroff, W. W.; Hubbard, A. (9 april 2005). ”Toward understanding the risk of secondary airborne infection: Emission of respirable pathogens”. J Occup Environ Hyg "2" (3): ss. 143–154. doi:. PMID 15764538.
- ^ Ahmed, N.; Hasnain, S. (9 april 2011). ”Molecular epidemiology of tuberculosis in India: Moving forward with a systems biology approach”. Tuberculosis "91" (5): ss. 407–413. doi:. PMID 21514230.
- ^ Griffith, D.; Kerr, C. (9 april 1996). ”Tuberculosis: Disease of the past, disease of the present”. J Perianesth Nurs "11" (4): ss. 240–245. doi:. PMID 8964016.
- ^ [a b] Nnoaham, K. E.; Clarke, A. (9 april 2008). ”Low serum vitamin D levels and tuberculosis: A systematic review and meta-analysis”. Int J Epidemiol "37": ss. 113–119. doi:. PMID 18245055.
- ^ ATS/CDC Statement Committee on Latent Tuberculosis Infection (9 juni 2000). ”Targeted Tuberculin Testing and Treatment of Latent Tuberculosis Infection”. MMWR: Recommendations and Reports "49" (RR-6): ss. 1–51. PMID 10881762.
- ^ [a b] Restrepo, B. I. (15 augusti 2007). ”Convergence of the tuberculosis and diabetes epidemics: Renewal of old acquaintances”. Clin Infect Dis "45": ss. 436–438. doi:.
- ^ Nijland, H. M. J.; Ruslami, R.; Stalenhoef, J. E.; Nelwan E. J.; Alisjahbana, B.; Nelwan, R. H.; van der Ven, A. J.; Danusantoso, H.; Aarnoutse, R. E.; van Crevel, R. (9 april 2006). ”Exposure to rifampicin is strongly reduced in patients with tuberculosis and type 2 diabetes”. Clin Infect Dis "43" (7): ss. 848–854. doi:. PMID 16941365.
- ^ van Zyl Smit, R. N.; Pai, M.; Yew, W. W.; Leung, C. C.; Zumla, A.; Bateman, E. D.; Dheda, K. (januari 2010). ”Global lung health: The colliding epidemics of tuberculosis, tobacco smoking, HIV and COPD”. European Respiratory Journal "35" (1): ss. 27–33. doi:. PMID 20044459.
- ^ Mayo Clinic staff. ”Tuberculosis: Causes” (på engelska). Mayo Clinic. Arkiverad från originalet den 22 oktober 2012. https://web.archive.org/web/20121022101646/http://www.mayoclinic.com/health/tuberculosis/DS00372/DSECTION%3Dcauses. Läst 25 februari 2013.
- ^ Kallmann, F. J.; Reisner, D. (9 april 1942). ”Twin studies on the significance of genetic factors in tuberculosis”. Am Rev Tuberc "16": ss. 593–617.
- ^ Tso, H. W.; Lau, Y. L.; Tam, C. M.; Wong, H. S.; Chiang, K. S. (9 april 2004). ”Associations between IL12B polymorphisms and tuberculosis in the Hong Kong Chinese population”. J Infect Dis "190" (5): ss. 913–919. doi:. PMID 15295696.
- ^ Mutlu, G.; Mutlu, E.; Bellmeyer, A.; Rubinstein, I. (9 april 2006). ”Pulmonary adverse events of anti-tumor necrosis factor-alpha antibody therapy”. Am J Med "119" (8): ss. 639–646. doi:. PMID 16887405.
- ^ [a b] SPIEGEL, DER. ”Tuberkulose nimmt in Deutschland weiter zu - DER SPIEGEL - Gesundheit” (på tyska). www.spiegel.de. https://www.spiegel.de/gesundheit/diagnose/tuberkulose-nimmt-in-deutschland-weiter-zu-a-1140079.html. Läst 19 april 2020.
- ^ name. ”Vi har stadig tuberkulose (TB) i Danmark” (på danska). www.ssi.dk. https://www.ssi.dk/aktuelt/nyheder/2019/vi-har-stadig-tuberkulose-tb-i-danmark. Läst 16 april 2020.
- ^ Mardy Lindqvist (2018). ”Henrik Riska gläds över allt bättre behandlingsresultat, men tusentals avled i tuberkulos ännu långt in på 1900-talet”. Finska Läkaresällskapets Handlingar. Finska Läkaresällskapet. sid. Årgång 178, Nr 2, sid 86-89. Arkiverad från originalet den 12 september 2021. https://web.archive.org/web/20210912161007/https://www.fls.fi/Site/Data/884/Files/Handlingar-lehti_218_16.pdf. Läst 23 december 2020.
- ^ ”Tuberkulosvaccination”. Filha rf - Finnish Lung Health Association. https://tuberkuloosi.fi/se/tuberkulos/tuberkulosvaccination/. Läst 23 december 2020.
- ^ ”Bra att veta om Vaccination mot tuberkulos”. Folkhälsomyndigheten. 26 oktober 2020. https://www.folkhalsomyndigheten.se/contentassets/f99eef512d7a4d12a0f1e2c0641f8a69/vaccination-bcg.pdf. Läst 22 december 2020.
- ^ ”Tuberkulosvaccin”. VaccinDirekt. https://vaccindirekt.se/vaccinationer/tuberkulos/. Läst 21 december 2020.
- ^ ”Vaccin mot tuberkulos (TB)”. Folkhälsomyndigheten. 17 september 2020. https://www.folkhalsomyndigheten.se/smittskydd-beredskap/vaccinationer/vacciner-a-o/tuberkulos-tb/. Läst 21 december 2020.
- ^ ”Helse i innvandrerbefolkningen” (på norska). Folkehelseinstituttet. https://www.fhi.no/nettpub/hin/grupper/helse-i-innvandrerbefolkningen/. Läst 3 april 2020.
- ^ ”Tuberkulos – sjukdomsstatistik — Folkhälsomyndigheten”. www.folkhalsomyndigheten.se. http://www.folkhalsomyndigheten.se/folkhalsorapportering-statistik/statistik-a-o/sjukdomsstatistik/tuberkulos/. Läst 18 februari 2020.
- ^ ”Läkartidningen”. www.lakartidningen.se. Arkiverad från originalet den 12 juni 2018. https://web.archive.org/web/20180612142114/https://lakartidningen.se/Functions/OldArticleView.aspx?articleId=15732ark. Läst 11 juni 2018.
- ^ [a b] Folkhälsomyndigheten (2014). Barnvaccinationsprogrammet i Sverige 2013, Årsrapport. Stockholm: Folkhälsomyndigheten. sid. 56. ISBN 978-91-7603-075-2. Arkiverad från originalet den 26 juni 2015. https://web.archive.org/web/20150626104421/https://www.folkhalsomyndigheten.se/pagefiles/18525/Barnvaccinationsprogramet-2013-Arsrapport.pdf. Läst 25 juni 2015
- ^ [a b] ”Tuberkulos ökar kraftigt i Sverige”. Dagens Nyheter. http://www.dn.se/nyheter/sverige/tuberkulos-okar-kraftigt-i-sverige/. Läst 21 augusti 2016.
- ^ ”Tuberkulos i Sverige 1 januari till 30 juni 2016”. Folkhälsomyndigheten. https://www.folkhalsomyndigheten.se/folkhalsorapportering-statistik/statistikdatabaser-och-visualisering/sjukdomsstatistik/tuberkulos/. Läst 16 november 2016.
- ^ [a b] ”Bericht zur Epidemiologie der Tuberkulose in Deutschland für 2014 (PDF)”. Robert Koch Institut. sid. 8-9. Arkiverad från originalet den 19 april 2020. https://web.archive.org/web/20200419081550/https://www.rki.de/DE/Content/InfAZ/T/Tuberkulose/Download/TB2014.pdf;jsessionid=DA614D8295EE3EDD67BAC7BF13798837.internet061. Läst 19 april 2020.
- ^ [a b] Bento, J.; Silva, A. S.; Rodrigues, F.; Duarte, R. (januari-februari 2011). ”Diagnostic tools in tuberculosis”. Acta medica portuguesa "24" (1): ss. 145–154. PMID 21672452.
- ^ Escalante, P. (2 juni 2009). ”In the clinic: Tuberculosis”. Annals of internal medicine "150" (11): ss. ITC61–614. PMID 19487708.
- ^ Foundation for Innovative New Diagnostics 2006, s. 36.
- ^ ”Mantoux test” (på engelska). Merriam-Webster. Arkiverad från originalet den 4 april 2013. https://web.archive.org/web/20130404220745/http://www.merriam-webster.com/dictionary/mantoux%20test. Läst 14 augusti 2013.
- ^ Rothel, J.; Andersen, P. (9 april 2005). ”Diagnosis of latent Mycobacterium tuberculosis infection: Is the demise of the Mantoux test imminent?”. Expert Rev Anti Infect Ther "3" (6): ss. 981–993. doi:. PMID 16307510.
- ^ Nahid, P.; Pai, M.; Hopewell, P. (9 april 2006). ”Advances in the diagnosis and treatment of tuberculosis”. Proc Am Thorac Soc "3" (1): ss. 103–110. doi:. PMID 16493157.
- ^ Pai, M.; Zwerling, A.; Menzies, D. (juni 2008). ”Systematic Review: T-Cell-Based Assays for the Diagnosis of Latent Tuberculosis Infection: An Update”. Ann. Intern. Med. "149" (3): ss. 1–9. PMID 18593687.
- ^ Reddy, J. R.; Kwang, J.; Lechtenberg, K. F.; Khan, N. C.; Prasad, R. B.; Chengappa, M. M. (januari 2002). ”An immunochromatographic serological assay for the diagnosis of Mycobacterium tuberculosis”. Comp. Immunol. Microbiol. Infect. Dis. "25" (1): ss. 21–27. doi:. PMID 11831744.
- ^ [a b] Onyebujoh, Phillip; Rook, Graham A. W. (december 2004). World Health Organization Disease Watch: Focus: Tuberculosis. Läst 7 oktober 2006.
- ^ [a b] Houben, E.; Nguyen, L.; Pieters, J. (9 april 2006). ”Interaction of pathogenic mycobacteria with the host immune system”. Curr Opin Microbiol "9" (1): ss. 76–85. doi:. PMID 16406837.
- ^ Khan & Rahman 2011, s. 401.
- ^ Herrmann J, Lagrange P (9 april 2005). ”Dendritic cells and Mycobacterium tuberculosis: which is the Trojan horse?”. Pathol Biol (Paris) "53" (1): ss. 35–40. PMID 15620608.
- ^ Agarwal, R.; Malhotra, P.; Awasthi, A.; Kakkar, N.; Gupta, D. (9 april 2005). ”Tuberculous dilated cardiomyopathy: An under-recognized entity?”. BMC Infect Dis "5" (1): s. 29. doi:. PMID 15857515. https://pubmed.ncbi.nlm.nih.gov/15857515/.
- ^ Kaufmann, S. (9 april 2002). ”Protection against tuberculosis: Cytokines, T cells, and macrophages”. Ann Rheum Dis "61 Suppl 2": ss. ii54–ii58. PMID 12379623.
- ^ [a b c] Grosset, J. (9 april 2003). ”Mycobacterium tuberculosis in the extracellular compartment: An underestimated adversary”. Antimicrob Agents Chemother "47" (3): ss. 833–836. doi:. PMID 12604509.
- ^ Kim, J.; Park, Y.; Kim, Y.; Kang, S.; Shin, J.; Park, I.; Choi, B. (9 april 2003). ”Miliary tuberculosis and acute respiratory distress syndrome”. Int J Tuberc Lung Dis "7" (4): ss. 359–364. PMID 12733492.
- ^ Parrish, N.; Dick, J.; Bishai, W. (9 april 1998). ”Mechanisms of latency in Mycobacterium tuberculosis”. Trends Microbiol "6" (3): ss. 107–112. doi:. PMID 9582936.
- ^ ”Tbc och sanatorier”. Riksarkivet. 23 oktober 2009. Arkiverad från originalet den 7 januari 2011. https://web.archive.org/web/20110107063138/http://www.riksarkivet.se/default.aspx?id=19617. Läst 14 augusti 2013.
- ^ ”Tuberkulose II” (på norska). Cappelen Damm Undervisning. Arkiverad från originalet den 10 november 2004. https://web.archive.org/web/20041110201941/http://norgeogverden.cappelen.no/n204ki07.htm. Läst 25 februari 2013.
- ^ WHO consolidated guidelines on drug-resistant tuberculosis treatment. Schweitz: Världshälsoorganisationen (WHO). 2019. ISBN 978-92-4-155052-9. https://apps.who.int/iris/bitstream/handle/10665/311389/9789241550529-eng.pdf?ua=1. Läst 5 december 2019
- ^ [a b] O'Brien, R. (9 april 1994). ”Drug-resistant tuberculosis: Etiology, management and prevention”. Semin Respir Infect "9" (2): ss. 104–112. PMID 7973169.
- ^ ”Update: Adverse event data and revised American Thoracic Society/CDC recommendations against the use of rifampin and pyrazinamide for treatment of latent tuberculosis infection—United States, 2003”. MMWR Morb Mortal Wkly Rep "52" (31): ss. 735–739. 9 april 2003. PMID 12904741. http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5231a4.htm.
- ^ [a b] ”Emergence of Mycobacterium tuberculosis with extensive resistance to second-line drugs—worldwide, 2000–2004”. MMWR Morb Mortal Wkly Rep "55" (11): ss. 301–305. 9 april 2006. PMID 16557213. http://www.cdc.gov/mmwr/preview/mmwrhtml/mm5511a2.htm.
- ^ Kuhlin, Johanna (2013). ”En fråga till Johanna Kuhlin”. Direkt (Läkare utan gränser) (3): sid. 5.
- ^ Fine, P.; Floyd, S.; Stanford, J.; Nkhosa, P.; Kasunga, A.; Chaguluka, S.; Warndorff, D.; Jenkins, P.; Yates, M.; Ponnighaus, J. (9 april 2001). ”Environmental mycobacteria in northern Malawi: Implications for the epidemiology of tuberculosis and leprosy”. Epidemiol Infect "126" (3): ss. 379–387. doi:. PMID 11467795.
- ^ Martin, C. (maj 2006). ”Tuberculosis vaccines: Past, present and future”. Curr Opin Pulm Med "12" (3): ss. 186–191. doi:. PMID 16582673.
- ^ ”Stop TB Partnership” (på engelska). Världshälsoorganisationen (WHO). Arkiverad från originalet den 31 december 2006. https://web.archive.org/web/20061231124211/http://www.stoptb.org/globalplan/. Läst 3 oktober 2006.
- ^ Kato, T.; Kanagawa, K.; Handa, K.; Shigematsu, I.; Yanagawa, H. (1 september 1968). ”A study on BCG vaccination by multiple-puncture method”. Kekkaku "43" (8): ss. 309–318.
- ^ ”WHO statement on BCG revaccination for the prevention of tuberculosis” (på engelska). Världshälsoorganisationen (WHO). 11 augusti 1995. Arkiverad från originalet den 25 mars 2009. https://web.archive.org/web/20090325104940/http://whqlibdoc.who.int/wer/WHO_WER_1995/WER1995_70_229-236%20%28N%C2%B032%29.pdf. Läst 9 augusti 2013.
- ^ Bannon, M. (9 april 1999). ”BCG and tuberculosis”. Arch Dis Child "80" (1): ss. 80–83. doi:. PMID 10325767.
- ^ ”WHO/UNICEF: Review of National Immunization Coverage 1980–2005 - South Africa” (på engelska). Världshälsoorganisationen (WHO); United Nations Children's Fund (Unicef). 1 augusti 2006. Arkiverad från originalet den 30 juni 2007. https://web.archive.org/web/20070630073246/http://www.who.int/immunization_monitoring/data/south_africa.pdf. Läst 8 juni 2007.
- ^ Skånberg, G.; Ekholm, L. (29 januari 2004). ”TUBERKULOS (BCG) – VACCINATION”. Barnhälsovården vid Örebro läns landsting. Arkiverad från originalet den 19 mars 2004. https://web.archive.org/web/20040319123609/http://www.orebroll.se/upload/Prim/Kansli/BHV/Dokument/Handboken/Kap%2011.18.%201.%20Tuberkulos%20%28BCG%29%20-%20vaccination.pdf. Läst 25 februari 2013.
- ^ Sadoff, Jerry (juni 2006). Advances in Tuberculosis Vaccine Strategies. Nature Reviews Microbiology (volym 4).
- ^ ”First U.S. Tuberculosis Vaccine Trial in 60 Years Begins” (på engelska). National Institute of Allergy and Infectious Diseases (NIAID). 26 januari 2004. Arkiverad från originalet den 24 september 2009. https://web.archive.org/web/20090924074417/http://www.nih.gov/news/pr/jan2004/niaid-26.htm. Läst 19 oktober 2007.
- ^ Hoft, Daniel F.; Blazevic, Azra; Abate, Getahun; Hanekom, Willem A.; Kaplan, Gilla; Soler, Jorge H.; Weichold, Frank; Geiter, Larry; Sadoff, Jerald C.; Horwitz, Marcus A. (15 november 2008). ”A New Recombinant Bacille Calmette-Guérin Vaccine Safely Induces Significantly Enhanced Tuberculosis-Specific Immunity in Human Volunteers”. The Journal of Infectious Diseases "198" (10): ss. 1491–1501. doi:. http://jid.oxfordjournals.org/content/198/10/1491.long.
- ^ Ha, S.; Jeon, B.; Youn, J.; Kim, S.; Cho, S.; Sung, Y. (9 april 2005). ”Protective effect of DNA vaccine during chemotherapy on reactivation and reinfection of Mycobacterium tuberculosis”. Gene Ther "12" (7): ss. 634–638. doi:. PMID 15690060.
- ^ Ibanga, H.; Brookes, R.; Hill, P.; Owiafe, P.; Fletcher, H.; Lienhardt, C.; Hill, A.; Adegbola, R.; McShane, H. (9 april 2006). ”Early clinical trials with a new tuberculosis vaccine, MVA85A, in tuberculosis-endemic countries: Issues in study design”. Lancet Infect Dis "6" (8): ss. 522–528. doi:. PMID 16870530.
- ^ McShane, H. (23 september 2010). "Improving BCG with MVA85A: An update on clinical trials". The Jenner Institute. Läst 2 oktober 2012.
- ^ Walsh, Fergus (4 februari 2013). ”Tuberculosis vaccine hopes dashed” (på engelska). BBC. Arkiverad från originalet den 8 juni 2013. https://web.archive.org/web/20130608034727/http://www.bbc.co.uk/news/health-21302518. Läst 14 augusti 2013.
- ^ Doherty, T. M.; Andersen, P. (oktober 2005). ”Vaccines for Tuberculosis: Novel Concepts and Recent Progress” (PDF). Clinical Microbiology Reviews "18" (4): ss. 687–702. doi:. https://pmc.ncbi.nlm.nih.gov/articles/PMC1265910/pdf/0018-05.pdf. Läst 1 mars 2009.
- ^ ”TB vaccine” (på engelska). Statens Serum Institut (SSI). Arkiverad från originalet den 17 juli 2007. https://web.archive.org/web/20070717164308/http://www.ssi.dk/sw13853.asp. Läst 1 mars 2009.
- ^ ”Statens Serum Institut (SSI), Intercell (ICLL), and Aeras Global Tuberculosis Vaccine Foundation (Aeras) announce the initiation of a clinical trial for a novel vaccine candidate” (på engelska). Aeras. 12 mars 2007. Arkiverad från originalet den 9 augusti 2013. https://web.archive.org/web/20130809123604/http://www.aeras.org/newscenter/news-detail.php?id=705. Läst 1 mars 2009.
- ^ ”Vaccine Discovery — Overview” (på engelska). Aeras. Arkiverad från originalet den 21 maj 2012. https://web.archive.org/web/20120521214609/http://www.aeras.org/our-approach/vaccine-development.php?discovery-overview. Läst 1 mars 2009.
- ^ ”Developing an effective tuberculosis (TB) vaccine” (på engelska). Crucell. Arkiverad från originalet den 2 december 2012. https://web.archive.org/web/20121202153627/http://www.crucell.com/R_and_D-Clinical_Development-Tuberculosis_Vaccine. Läst 1 mars 2009.
- ^ Dietrich, J.; Andersen, C.; Rappuoli, R.; Doherty, T. M.; Jensen, C. G.; Andersen, P. (9 april 2006). ”Mucosal Administration of Ag85B-ESAT-6 Protects against Infection with Mycobacterium tuberculosis and Boosts Prior Bacillus Calmette-Guérin Immunity” (PDF). Journal of Immunology "177": ss. 6353–6360. http://www.jimmunol.org/cgi/reprint/177/9/6353.pdf. Läst 1 mars 2009.
- ^ Webber, David; Kremer, Michael. Stimulating Industrial R&D for Neglected Infectious Diseases: Economic Perspectives (PDF). Bulletin of the World Health Organization 79(8), 2001, pp. 693–801.
- ^ Barder, Owen; Kremer, Michael; Williams, Heidi (2006). "Advance Market Commitments: A Policy to Stimulate Investment in Vaccines for Neglected Diseases," Arkiverad 5 november 2006 hämtat från the Wayback Machine. The Economists' Voice (volym 3, nummer 3).
- ^ ”Aeras Receives New Grant from the Gates Foundation” (på engelska). Aeras. 9 april 2007. Arkiverad från originalet den 27 december 2007. https://web.archive.org/web/20071227023805/http://www.aeras.org/news/Gatesgrant2007.html. Läst 9 augusti 2013.
- ^ [a b] ”Global tuberculosis control - surveillance, planning, financing” (på engelska). Världshälsoorganisationen (WHO). 9 april 2006. Arkiverad från originalet den 12 december 2006. https://web.archive.org/web/20061212123736/http://www.who.int/tb/publications/global_report/en/index.html. Läst 13 oktober 2006.
- ^ ”WHO report 2008: Global tuberculosis control” (på engelska). Världshälsoorganisationen (WHO). 9 april 2008. Arkiverad från originalet den 26 juli 2009. https://web.archive.org/web/20090726124538/http://www.who.int/tb/publications/global_report/2008/annex_3/en/index.html. Läst 13 april 2009.
- ^ ”London tuberculosis rates now at Third World proportions” (på engelska). PR Newswire; Stop TB Partnership. 4 december 2002. Arkiverad från originalet den 14 maj 2011. https://web.archive.org/web/20110514134335/http://www.prnewswire.co.uk/cgi/news/release?id=95088. Läst 3 oktober 2006.
- ^ Iademarco, M. F.; Castro, K. G. (9 april 2003). ”Epidemiology of tuberculosis”. Seminars in respiratory infections "18" (4): ss. 225–240. doi:. PMID 14679472.
- ^ Sobero, R.; Peabody, J. (9 april 2006). ”Tuberculosis control in Bolivia, Chile, Colombia and Peru: Why does incidence vary so much between neighbors?”. Int J Tuberc Lung Dis "10" (11): ss. 1292–1295. PMID 17131791.
- ^ [a b] ”WHO report 2007: Global tuberculosis control - Surveillance, planning, financing” (på engelska). Världshälsoorganisationen (WHO). 9 april 2007. Arkiverad från originalet den 27 februari 2008. https://web.archive.org/web/20080227022810/http://www.who.int/tb/publications/global_report/2007/pdf/full.pdf. Läst 9 augusti 2013.
- ^ ”Notification rates of tuberculosis: by NHS Regional Office area, 1990-2001: Regional Trends 37” (på engelska). Office for National Statistics. Arkiverad från originalet den 11 januari 2009. https://web.archive.org/web/20090111024147/http://www.statistics.gov.uk/StatBase/ssdataset.asp?vlnk=5963&Pos=1&ColRank=1&Rank=224. Läst 13 oktober 2006.
- ^ ”Tuberculosis in the United States, 2004” (på engelska). Centers for Disease Control (CDC). 17 mars 2005. Arkiverad från originalet den 23 april 2009. https://web.archive.org/web/20090423234343/http://www.cdc.gov/od/oc/Media/pressrel/fs050317.htm. Läst 6 oktober 2006.
- ^ Al-Azem, A.; Kaushal Sharma, M.; Turenne, C.; Hoban, D.; Hershfield, E.; MacMorran, J.; Kabani, A. (24–27 september 1998). ”Rural outbreaks of mycobacterium tuberculosis in a Canadian province.” (på engelska). Faculty of Medicine vid University of Manitoba. Arkiverad från originalet den 13 oktober 2008. https://web.archive.org/web/20081013234148/http://gateway.nlm.nih.gov/MeetingAbstracts/ma?f=102188560.html. Läst 25 februari 2013.
- ^ ”WHO report 2006: Global tuberculosis control - Surveillance, planning, financing” (på engelska). Världshälsoorganisationen (WHO). 9 april 2006. Arkiverad från originalet den 26 juli 2009. https://web.archive.org/web/20090726124358/http://www.who.int/tb/publications/global_report/2006/pdf/full_report_correctedversion.pdf. Läst 13 oktober 2006.
- ^ ”2005 Surveillance Slides” (på engelska). Centers for Disease Control and Prevention (CDC). 12 september 2006. Arkiverad från originalet den 23 november 2006. https://web.archive.org/web/20061123122326/http://www.cdc.gov/nchstp/tb/pubs/slidesets/surv/surv2005/default.htm. Läst 13 oktober 2006.
- ^ Chaisson, R. E.; Martinson, N. A. (9 april 2008). ”Tuberculosis in Africa—combating an HIV-driven crisis”. N Engl J Med "358" (11): ss. 1089–1092. doi:. PMID 18337598. http://content.nejm.org/cgi/content/full/358/11/1089?query=TOC.
- ^ Davies, P. D. O.; Yew, W. W.; Ganguly, D.; Davidow, A. L.; Reichman, L. B.; Dheda, K.; Rook, G. A. (9 april 2006). ”Smoking and tuberculosis: The epidemiological association and pathogenesis”. Trans R Soc Trop Med Hyg "100": ss. 291–298. doi:. PMID 16325875.
- ^ Jha, Prabhat; Jacob, Binu; Gajalakshmi, Vendhan; Gupta, Prakash C.; Dhingra, Neeraj; Kumar, Rajesh; Sinha, Dhirendra N.; Dikshit, Rajesh P.; Parida, Dillip K.; Kamadod, Rajeev; Boreham, Jillian; Peto, Richard (9 april 2008). ”A nationally representative case–control study of smoking and death in India”. N Engl J Med "358" (11): ss. 1137–1147. doi:. PMID 18272886. http://content.nejm.org/cgi/content/full/358/11/1137?query=TOC.
- ^ Oeltmann, John E.; Kammerer, J. Steve; Pevzner, Eric S.; Moonan, Patrick K. (26 januari 2009). ”Tuberculosis and Substance Abuse in the United States, 1997-2006” (på engelska). JAMA Internal Medicine. http://archinte.jamanetwork.com/article.aspx?articleid=414727. Läst 25 februari 2013.
- ^ [a b] Strachan, D. P.; Powell, K. J.; Thaker, A.; Millard, F. J.; Maxwell, J. D. (1 februari 1995). ”Vegetarian diet as a risk factor for tuberculosis in immigrant south London Asians”. Thorax "50" (2): ss. 175–180. doi:. PMID 7701458.
- ^ Davis, L. (1 augusti 1995). ”Vegetarian diet and tuberculosis in immigrant Asians”. Thorax "50" (8): ss. 915–916. doi:. PMID 7570453. PMC: 474924. https://pmc.ncbi.nlm.nih.gov/articles/PMC474924/pdf/thorax00313-0111d.pdf.
- ^ Ustianowski, A.; Shaffer, R.; Collin, S.; Wilkinson, R. J.; Davidson, R. N. (juni 2005). ”Prevalence and associations of vitamin D deficiency in foreign-born persons with tuberculosis in London”. The Journal of infection "50" (5): ss. 432–437. doi:. PMID 15907552.
- ^ Schaible, U. E.; Kaufmann, S. H. (maj 2007). ”Arkiverade kopian”. PLoS medicine "4" (5): s. e115. doi:. PMID 17472433. PMC: 1858706. Arkiverad från originalet den 26 december 2014. https://web.archive.org/web/20141226035229/http://www.plosmedicine.org/article/info:doi/10.1371/journal.pmed.0040115. Läst 23 maj 2009.
- ^ Lönnroth, K.; Raviglione, M. (oktober 2008). ”Global epidemiology of tuberculosis: Prospects for control”. Seminars in respiratory and critical care medicine "29" (5): ss. 481–491. doi:. PMID 18810682.
- ^ Davies, P. D. (9 april 2003). ”The world-wide increase in tuberculosis: How demographic changes, HIV infection and increasing numbers in poverty are increasing tuberculosis”. Annals of medicine "35" (4): ss. 235–243. doi:. PMID 12846265.
- ^ Spence, D. P.; Hotchkiss, J.; Williams, C. S.; Davies, P. D. (1 september 1993). ”Tuberculosis and poverty”. BMJ (Clinical research ed.) "307" (6907): ss. 759–761. doi:. PMID 8219945. PMC: 1696420. https://pmc.ncbi.nlm.nih.gov/articles/PMC1696420/pdf/bmj00040-0017.pdf.
Tryckta källor
- Bloom, Barry R. (1994) (på engelska). Tuberculosis: Pathogenesis, protection, and control. Washington, D.C.: ASM Press. ISBN 978-1-55581-072-6
- Briggs, Katharine Mary (1976) (på engelska). An Encyclopedia of Fairies: Hobgoblins, Brownies, Bogies, & Other Supernatural Creatures. Pantheon Books. ISBN 0-394-73467-X
- Foundation for Innovative New Diagnostics (2006) (på engelska). Diagnostics for Tuberculosis: Global Demand and Market Potential. Genève: Världshälsoorganisationen (WHO). ISBN 978-92-4-156330-7
- Ghosh, Amit K.; Habermann, Thomas M. (2008) (på engelska). Mayo Clinic internal medicine: Concise textbook. Rochester: Mayo Clinic Scientific Press. ISBN 978-1-4200-6749-1
- Gibson, Peter G.; Abramson, Michael; Wood-Baker, Richard; Volmink, Jimmy; Hensley, Michael; Costabel, Ulrich (2005) (på engelska). Evidence-Based Respiratory Medicine. Oxford: Blackwell. ISBN 978-0-7279-1605-1
- Hannaway, Caroline (2008) (på engelska). Biomedicine in the twentieth century: Practices, policies, and politics. Amsterdam: IOS Press. ISBN 978-1-58603-832-8
- Jindal, S. K.; Shankar, P. S.; Raoof, Suhail; Gupta, Dheeraj; Aggarwal, Ashutosh N. (2011) (på engelska). Textbook of pulmonary and critical care medicine. New Delhi: Jaypee Brothers Medical Publishers. ISBN 978-93-5025-073-0
- Khan, M. R.; Rahman, M. Ekhlasur (2011) (på engelska). Essence of Pediatrics (4). Elsevier India. ISBN 978-81-312-2804-3
- Kumar, Vinay; Abbas, Abul K.; Fausto, Nelson; Mitchell, Richard N. (2007) (på engelska). Robbins Basic Pathology (8). Saunders Elsevier. ISBN 978-1-4160-2973-1
- Laumann, Edward O.; Gagnon, John H.; Michael, Robert T.; Michaels, Stuart (1994) (på engelska). The Social Organization of Sexuality: Sexual Practices in the United States. University of Chicago Press. ISBN 0-226-47020-2
- Mandell, Gerald L.; Bennett, John E.; Dolin, Raphael (2010) (på engelska). Mandell, Douglas, and Bennett's principles and practice of infectious diseases. Philadelphia: Churchill Livingstone/Elsevier. ISBN 978-0-443-06839-3
- Ochei, J.; Kolhatkar, Arundhati (2000) (på engelska). Medical Laboratory Science: Theory and Practice. New Delhi: Tata McGraw-Hill. ISBN 0-07-463223-X
- Persson, Sheryl (2010) (på engelska). Smallpox, Syphilis and Salvation: Medical Breakthroughs That Changed the World. ReadHowYouWant.com. ISBN 978-1-4587-6712-7
- Semba, Richard D.; Bloem, Martin W.; Piot, Peter (2008) (på engelska). Nutrition and health in developing countries (2). Totowa: Humana Press. ISBN 978-1-934115-24-4
Vidare läsning
- Berg, Henrik (1897). Om lungsot, dess orsaker, kännetecken, förebyggande och botande. Stockholm: N. J. Schedin. Libris 1662436. https://runeberg.org/bhlungsot
- Henschen, Salomon Eberhard (1893). Om lungsot och tuberkulos. Föreningen Heimdals folkskrifter, 99-1250994-3 ; 3. Stockholm: F. & G. Beijers Bokf.-aktb. Libris 1622657. https://runeberg.org/hselungsot/
- Hont, Gabor (2010). Tuberkulos : en temaskrift om världens mest spridda infektionssjukdom ([Ny utg.]). Stockholm: Hjärt-Lungfonden. Libris 11926750. ISBN 9789197840439
- Liedbeck, Jacob (1841). Gifves det läkemedel emot lungsot? : eller beskrifning om lungsot och dess förekommande, samt meddelande af rön och försök med ett nytt läkemedel för denna sjukdom, ur andras och egen erfarenhet. Upsala: Lundequist. Libris 12049694. https://archive.org/details/b30359570
- Nilsson, Ingrid; Westin-Järvinen, Carin (1990). Omvårdnad inom sanatorieverksamheten i historiskt perspektiv : en litteraturstudie. Stockholm: Institutionen för vårdlärarutbildning, Högsk. för lärarutbildning i Stockholm. Libris 9442764
- Petrini, Björn (2004). Tbc - dödsängelns budbärare : om tuberkelbacillen och andra mångsidiga mykobakterier. Järvsö: Bauer bok. Libris 9591688. ISBN 91-973788-3-6
- Puranen, Bi; Zetterholm, Tore; Dahlström, Gil (1987). Förälskad i livet : en bok om tuberkulosens historia. Höganäs: Wiken. Libris 8369394. ISBN 91-7024-395-6
- Puranen, Bi (1984). Tuberkulos : en sjukdoms förekomst och dess orsaker : Sverige 1750-1980. Umeå studies in economic history, 0347-254X ; 7. [Umeå]: [Förf.]. Libris 7615444. ISBN 91-7174-180-1
Externa länkar
 Scholia har publikationer om Tuberkulos
Scholia har publikationer om Tuberkulos- Tuberkulos på 1177 Vårdguiden
- Tuberkulos på Folkhälsomyndigheten
|
Media som används på denna webbplats
Folkhälsomyndigheten Antal fall av tuberkulos i Sverige 1989-2017 per födelseland
This technician is in the process of correctly placing a Mantoux tuberculin skin test in this recipient’s forearm, which will cause a 6mm to10mm wheal, i.e., a raised area of skin surface, to form at the injection site. The Mantoux tuberculin skin test is used to evaluate people for latent tuberculosis (TB) infection. In the United States, this skin test consists of an intradermal injection of exactly one tenth of a milliliter (mL) of tuberculin, which contains 5 tuberculin units. Correct placement of this intradermal injection involves inserting the needle bevel slowly at a 5° to 15° angle. The needle bevel is advanced through the epidermis, the superficial layer of skin, approximately 3mm so that the entire bevel is covered and lies just under the skin surface. A tense, pale wheal that is 6mm to 10mm in diameter appears over the needle bevel.
Författare/Upphovsman: Gutierrez MC, Brisse S, Brosch R, Fabre M, Omaïs B, Marmiesse M, Supply P, Vincent V., Licens: CC BY 3.0
Phylogenetic Position of the Tubercle Bacilli within the Genus Mycobacterium. The blue triangle corresponds to tubercle bacilli sequences that are identical or differing by a single nucleotide. The sequences of the genus Mycobacterium that matched most closely to those of M. tuberculosis were retrieved from the BIBI database (http://pbil.univ-lyon.fr/bibi/) and aligned with those obtained for 17 smooth and MTBC strains. The unrooted neighbor-joining tree is based on 1,325 aligned nucleotide positions of the 16S rRNA gene. The scale gives the pairwise distances after Jukes-Cantor correction. Bootstrap support values higher than 90% are indicated at the nodes.
Predominantly white poster with black and red lettering. Title at top of poster. Visual image is an illustration of a man holding a handkerchief over his mouth. Caption and publisher information below illustration.
Photomicrograph of a sputum sample containing Mycobacterium tuberculosis. M. tuberculosis bacteria can attack any part of the body, but usually the lungs causing Tuberculosis. It is spread when infected individuals cough or sneeze, releasing microdroplets into the air that contain the bacteria, which others then inhale.
Författare/Upphovsman: user:shakko, Licens: CC BY-SA 3.0
Hippocrates. Cast
Under a high magnification of 15549x, this scanning electron micrograph (SEM) depicted some of the ultrastructural details seen in the cell wall configuration of a number of Gram-positive Mycobacterium tuberculosis bacteria. As an obligate aerobic organism M. tuberculosis can only survive in an environment containing oxygen. This bacterium ranges in length between 2 - 4 microns, and a width between 0.2 - 0.5 microns. See PHIL 9997 for a colorized version of this image.
TB bacteria become active, and begin to multiply, if the immune system can't stop them from growing. The bacteria attack the body and destroy tissue. If in the lungs, the bacteria can actually create a hole in the lung tissue. Some people develop active TB disease soon after becoming infected, before their immune system can fight off the bacteria. Other people may get sick later, when their immune system becomes weak for another reason.
Babies and young children often have weak immune systems. People infected with HIV, the virus that causes AIDS, have very weak immune systems. Other people can have weak immune systems, too, especially people with any of these conditions: substance abuse; diabetes mellitus; silicosis; cancer of the head or neck; leukemia or Hodgkin's disease; severe kidney disease; low body weight; certain medical treatments (such as corticosteroid treatment or organ transplants); specialized treatment for rheumatoid arthritis, or Crohn's diseaseTuberculosis treatment in Kuopio, Finland in 1934
Combattez la Tuberculose [fight Tuberculosis]
- whole: 15 small images, captioned in red, are arranged around a centrally positioned bar chart, its accompanying text is
in black. The title is placed across the top and the bottom in white against black horizontal bands. image: three images showing the spread of Tuberculosis through spitting, breathing in dust and sharing bottles. Four images demonstrating behaviour encouraging Tubculosis, including intemperance, over-work, not opening windows and living in dirty and dusty conditions. Four images showing preventive measures, including the seeing a doctor, receiving sun and fresh air, rest and healthy food. Four images showing precautionary measures including destroying spittle, covering the mouth when coughing, not sharing utensils and sleeping alone. text: COMBATTEZ LA TUBERCULOSE COMMENT ELLE SE PROPAGE Crachats et postillons. Poussi�res respir�es ou aval�es. Objets port�s � la bouche. LES ALLI�S DE LA TUBERCULOSE Intemp�rance. Surmenage. Fen�tres ferm�es. Locaux sales et poussi�reux. LES RAVAGES DE LA TUBERCULOSE COMPAR�S � CEUX DES AUTRES MALADIES. VOUS POUVEZ ET DEVEZ �VITER LA TUBERCULOSE [a bar chart shows the number of Tuberculosis cases compared to those of Measles, Whooping-cough, Typhoid, Diptheria and Scarlet fever] Un d�c�s sur HUIT est d� � la Tuburculose La Tuberculose est un p�ril national, La Combattre est un devoir patriotique. La Tuberculose peut et doit �tre vaincue. les Pouvoirs publics et les initiatives priv�es ont engag� la lutte contre ce mal. Soutenez-les : Aidez-les LES ENNEMIS DE LA TUBERCULOSE Le M�decin. Soleil et Grand air. Repos. Nourriture saine. PR�CAUTIONS QU' UN TUBERCULEUX DOIT PRENDRE Recueillir et d�truire ses crachats. Prot�ger sa bouche en toussant ou �ternuant. Couverts et ustensiles � soi. Dormir seul. COMBATTEZ LA TUBERCULOSE DEVAMBEZ, IMP. PARIS COMMISSION AM�RICAINE DE PR�SERVATION CONTRE LA TUBERCULOSE EN FRANCE _ BUREAU DE LA TUBERCULOSE CROIX-ROUGE AM�RICAINE VISA No. 10.469. [Fight Tuberculosis. How It Spreads: spit and spittle; dust inhaled or swallowed; objects lifted to the mouth. Allies Of Tuberculosis: intemperance; overwork; closed windows; dirty, dusty premises. The ravages caused by tuberculosis compared with those caused by other illnesses. You can and must avoid tuberculosis [bar chart]. One death in eight is due to Tuberculosis. Tuberculosis is a national danger, fighting it is a patriotic duty. Tuberculosis can and must be vanquished. The public authorities and private initiatives have joined battle against this evil. Support them: Help them. The Enemies of Tuberculosis: the doctor, sun and fresh air, rest, healthy food. Precautions a T.B. sufferer must take: Collecting and destroying his spittle; covering his mouth when coughing or sneezing; keeping his plates and cutlery to himself; sleeping alone. Fight Tuberculosis. American Commission for Safeguarding against Tuberculosis in France. Tuberculosis
Office, American Red Cross.]Författare/Upphovsman: Sbw01f, Licens: CC BY 3.0
World map showing reported cases of tuberculosis per 100,000 citizens. Red = >300, orange = 200-300; yellow = 100-200; green 50-100; blue = <50 and grey = n/a.
Författare/Upphovsman: Mikael Häggström, Licens: CC BY-SA 3.0
Huvudsymtomen vid lungtuberkulos.
"Several new types of TB drugs currently under development are shown here with their mechanisms of action. NIAID has supported the development of two of these compounds, SQ-109 and PA-824, which are denoted by asterisks (*) above."
Författare/Upphovsman: Y tambe, Licens: CC BY-SA 3.0
An apparatus for BCG vaccination using in Japan (管針, or Kuchiki's needle) and Ireland. Disposable apparatus of 4-5 cm length, with nine short needles for multi-puncture vaccination. Photo with ampules of BCG and saline.
Författare/Upphovsman: CFCF, Licens: CC BY-SA 4.0
Huvudsymptom vid extrapulmonär tuberkulos, som beskrivna i w:en:Tuberculosis.
Tbc-patienterna på Söderby sanatorium får frisk luft under en vilotimme i det fria.
Författare/Upphovsman: TimVickers, Licens: CC BY-SA 3.0
Antal rapporterade fall av tuberkulos mellan 1980-2006.






















