Svaveldioxid
| Svaveldioxid | |||
  | |||
| Systematiskt namn | Svavel(IV)dioxid | ||
|---|---|---|---|
| Kemisk formel | SO2 | ||
| Molmassa | 64,07 g/mol | ||
| Utseende | Färglös gas | ||
| CAS-nummer | 7446-09-5 | ||
| SMILES | O=S=O | ||
| Egenskaper | |||
| Densitet | 2,551 × 10-3 g/cm³ | ||
| Löslighet (vatten) | 115,8 g/l (20 °C) | ||
| Smältpunkt | -75,5 °C | ||
| Kokpunkt | -10,0 °C | ||
| Faror | |||
| Huvudfara |
| ||
| NFPA 704 | |||
| LD50 | 3000 ppm (inhalerad) | ||
| SI-enheter & STP används om ej annat angivits | |||
Svaveldioxid, SO2, är en färglös och hostretande gas. Gasen bildas naturligt då biologiskt material bryts ner. Den uppstår även vid förbränning av fossila och andra svavelhaltiga ämnen. I vatten löser den sig lätt varvid svavelsyrlighet bildas. Den största naturliga källan till svaveldioxid är vulkaner.
Då gasen kommit ut i atmosfären oxideras den till svaveltrioxid (2 SO2 + O2 → 2 SO3) som sedan med vatten bildar svavelsyra (SO3 + H2O → H2SO4), vilket bidrar till försurning.
Hygieniskt gränsvärde: 2 ppm.
Direkt inandning av halter över 400-500 ppm kan vara livshotande.
Som konserveringsmedel i livsmedel betecknas svaveldioxid med E-nummer E 220.
Struktur och bindning
Svaveldioxid är en böjd molekyl med C2v-symmetri. Bindningen mellan svavel och syre kan med valensbindningsteori, som enbart tar hänsyn till s- och p-orbitalerna, beskrivas med resonans mellan två resonansstrukturer i enlighet med bilden nedan.
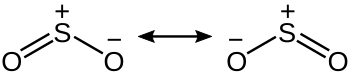
Dessa resonansstrukturer med en laddning på svavelatomen förklarar varför svaveldioxidmolekylen är böjd, till skillnad mot exempelvis koldioxid, som är en rak molekyl. Svavel-syrebindningen i svaveldioxid har ett bindningstal på 1,5.
Produktion
Svaveldioxid produceras genom att man bränner svavel i luft eller ren syrgas.
Det produceras även när man bränner svavelväte.
Användning
Svaveldioxid används främst för tillverkning av svavelsyra genom vidareoxidation till svaveltrioxid som tillsammans med vatten bildar svavelsyra. Eftersom svaveldioxid kondenserar vid -10 °C så kan gasen lätt göras flytande med till exempel torris och fraktas lätt.
I pappers- och massaindustrin används det i sulfitprocessen för tillverkning av kemisk pappersmassa.
Även i sulfatprocessen används SO2, bland annat för pH-justering. I blekeriet används SO2 även för att ta bort rester av väteperoxid (restVP).
Det används även som konserveringsmedel (nummer E 220) i livsmedelsindustrin, särskilt i torkad frukt, olika frukt- och grönsaksberedningar, potatismospulver, fiskprodukter, senap, öl och vin.[1] Utöver det även för att bleka och gulfärga torkade aprikoser.[källa behövs] Svaveldioxid och sulfiter är effektiva mot bakterier och har även antioxidativ effekt.[1]
Utsläpp
I Sverige har svaveldioxidutsläppen minskat kraftigt sedan 1970-talet. År 1980 låg utsläppen på cirka 500 000 ton och hade år 1990 minskat med 79% till cirka 105 000 ton. Därefter har utsläppen fortsatt minska och var 2009 nere i cirka 30 000 ton, vilket är en minskning med 72% jämfört med 1990, och 94% jämfört med 1980. Orsaken till minskningen är framför allt förbättrad rökgasrening i stora förbränningsanläggningar och inom industrin samt en övergång till svavelfattig olja. Ersättning av kol och olja med biobränslen har också minskat utsläppen.[2]
Källor
- Anders Karlén. Svaveldioxidens inverkan på mark och skog, sjöar, vattendrag och fisk : översikt. Allmänna Förlaget. ISBN 91-7186-009-6.
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, tidigare version.
Fotnoter
- ^ [a b] ”E 220 - Svaveldioxid”. Livsmedelsverket. http://www.livsmedelsverket.se/livsmedel-och-innehall/tillsatser-e-nummer/sok-e-nummer/e-220---svaveldioxid/. Läst 28 april 2016.
- ^ Naturvårdsverket
Se även
Media som används på denna webbplats
The structure and bonding of the sulfur dioxide. Sulfur-dioxide-2D.svg.
Space-filling model of the sulfur dioxide molecule, SO2
Resonance structures of the sulfur dioxide molecule, SO2. Computational chemistry has found that an expanded d-orbital model is not a very stabilising interaction and therefore not an important contributor to bonding in SO2, hence its omission in this image.
Globally Harmonized System of Classification and Labelling of Chemicals (GHS) pictogram for toxic substances
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.






