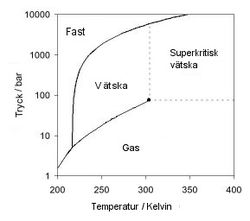
Superkritisk vätska

En superkritisk vätska är ett ämne som befinner sig under så högt tryck och temperatur att fasgränsen mellan vätska och gas har försvunnit.
Allmänt
Den tryck- och temperaturpunkt ovanför vilken superkritiska vätskor bildas kallas den termodynamiska kritiska punkten. När förhållandena närmar sig den kritiska punkten, blir gasfasens densitet allt närmare vätskefasens tills dessa inte längre går att skilja åt.
Superkritiska vätskor har den unika förmågan att som en gas kunna diffundera genom fasta material, men även lösa upp ämnen som en vätska. Dessutom kan ämnets densitet regleras genom temperatur- och tryckändringar. Det här gör superkritiska vätskor lämpliga som lösningsmedel i vissa sammanhang. Superkritisk torkning med koldioxid används till exempel för att extrahera vätskan från en aerogel tillverkad med sol-gel-metoden. Då det inte finns någon gränsyta mellan vätska och gas finns det heller inte någon ytspänning eller kapillärkraft som kan orsaka krympning och sprickor. En process som utförs bortom den kritiska punkten kallas en superkritisk process.
Vatten
Den kritiska punkten för vatten är vid 647 K (374 °C) och 22,064 MPa (218 atm).[1] Vid tillstånd med tryck och temperatur över dessa värden är vatten en superkritisk vätska utan någon gräns mellan vätske- och gasfas.
Se även
Källor
- ^ International Association for the Properties of Water and Steam, 2007.
Media som används på denna webbplats
Tryck-temperatur-fasdiagram för koldioxid. Gjord för att visa fenomenet superkritisk vätska.
Phase diagram of carbon dioxide. Temperature on x-axis, Pressure on Y-axis (logaritmic).