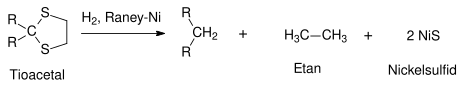Raneynickel
Raneynickel (engelska: Raney nickel, den särskrivna varianten är även vanlig på svenska, men ihopskrivet är korrekt[1]) är en fast katalysator som består av fina korn av en nickel-aluminium-legering. Raneynickel används i många industriella processer. Den utvecklades 1926 av den amerikanske ingenjören Murray Raney[2] som en alternativ katalysator för hydrogenering av vegetabiliska oljor i industriella processer. På senare tid har den använts som en heterogen katalysator (det vill säga en katalysator som befinner sig i en annan fas än reaktanterna) för syntes av olika organiska föreningar, främst via hydrogeneringsreaktioner.
Raneynickel produceras genom att en bit nickel-aluminium-legering behandlas med koncentrerad natriumhydroxid. Denna behandling kallas aktivering, då den skapar den struktur som behövs för att materialet ska kunna katalysera reaktioner (de flesta katalysatorer kräver någon form av aktivering för att fungera ordentligt). Behandlingen löser ut det mesta av aluminiumet ur legeringen och kvar blir en porös struktur. Denna struktur har en stor yta, vilket innebär hög katalytisk aktivitet. En typisk katalysator innehåller omkring 85 vikt-procent nickel, ungefär två nickelatomer för varje aluminiumatom. Det kvarvarande aluminiumet hjälper till att behålla den porösa strukturen.
Raney är ett registrerat varumärke som tillhör W. R. Grace and Company. Endast deras produkter, från divisionen Davison, kan egentligen kallas "Raney nickel". Någon speciell allmän term finns dock inte på svenska.
Tillverkning
Tillverkning av legering
Legeringen kan tillverkas kommersiellt genom att smälta den aktiva metallen (i detta fall nickel, men även järn och koppar kan användas i "raney-liknande" katalysatorer) och aluminium i en degel och släcka den resulterande smältan, som sedan krossas till ett fint mjöl.[3] Detta mjöl kan sedan silas för att få ett visst partikelstorleksintervall, beroende på vilken tillämpning som katalysatorn ska användas till.
Den ursprungliga legeringssammansättningen är viktig eftersom släckningsprocessen producerar ett antal olika Ni/Al-faser med olika egenskaper, vilket kan ge olika porositet. Oftast är viktförhållandet mellan nickel och aluminium 1:1, samma förhållande som Murray Raney använde när han upptäckte raneynickel. Under släckningen kan en tredje metall, såsom zink eller krom sättas till. Denna fungerar då som "promotor" (en substans som höjer katalysatorns aktivitet).[3] Att sätta till en tredje metall gör dock att fasdiagrammet blir ternärt med nya, olikartade egenskaper.
Aktivering
Katalysatorns porösa struktur uppstår då aluminium selektivt urlakas från legeringen med hjälp av en natriumhydroxidlösning (NaOH). Följande förenklade formel beskriver reaktionen:
- 2Al + 2NaOH + 6H2O → 2Na[Al(OH)4] + 3H2
För att natriumaluminat (Na[Al(OH)4]) ska bildas krävs en hög koncentration (upp till 5 molar) natriumhydroxid, annars bildas aluminiumhydroxid som utfaller som bayerit.[3] Bayerit kan blockera porer och således sänka katalysatorns aktivitet. Katalysatorns ytegenskaper beror till stor del på reaktionens temperatur. Temperaturen varierar oftast mellan 70 och 100 °C. Arean tenderar att minska med ökande temperatur.[4] Detta beror på strukturella förändringar i katalysatorn som kan jämföras med sintring.
Innan katalysatorn lagras kan den tvättas med destillerat vatten för att få bort spår av natriumaluminat. För att förhindra oxidation är syrefritt vatten att föredra. Oxidation skulle accelerera katalysatorns "åldrande". Åldrande innebär att en katalysators aktivitet gradvis minskar.[3]
Egenskaper
För blotta ögat ser raneynickel ut som ett fint fördelat grått pulver. Mikroskopiskt ser varje partikel ut som ett tredimensionellt nät med porer av olika storlek och form som bildats vid urlakningen. Raneynickel är strukturellt och termiskt stabilt trots att det har en stor BET-yta. Den stora ytan ger katalysatorn en hög aktivitet. Då raneynickel inte bryts ner vid höga temperaturer är det en ideal katalysator för många högtemperaturreaktioner. Dessutom är katalysatorn olöslig i de flesta lösningsmedel, med undantag av vissa mineralsyror som saltsyra. Dess höga densitet gör också att raneynickel lätt kan separeras från en vätska efter en reaktion.
Under aktiveringen lakas formerna NiAl3 och Ni2Al3 ut, medan det aluminium som finns kvar finns i form av NiAl. Att laka ut ett ämne från vissa faser men inte från andra kallas "selektiv urlakning". NiAl-fasen gör katalysatorn termiskt och strukturellt stabil, vilket gör att den inte åldras så lätt.[4] Denna motståndskraft mot åldrande gör att raneynickel kan lagras och användas på nytt under längre perioder. Nyaktiverad raneynickel föredras dock för laboratoriebruk, och kommersiell raneynickel finns i både aktiverad och icke-aktiverad form.
Arean bestäms vanligen med hjälp av en BET-mätning med en gas som adsorberas på metalliska ytor, såsom väte. Denna metod har visat att nästan all tillgänglig yta är täckt av nickel.[3] Då nickel är den aktiva metallen vid katalys så innebär en större nickelyta högre katalytisk aktivitet, eftersom flera molekyler kan adsorberas och fås att reagera samtidigt över katalysatorn. Kommersiellt raneynickel har en genomsnittlig nickelyta på 100 m² per gram katalysator.[3]
Tillämpningar
Raneynickel används i ett stort antal industriella processer och speciellt vid syntes av organiska föreningar på grund av dess stabilitet och höga katalytiska aktivitet.[3][5][6]
Industriella tillämpningar
Följande reaktion, där bensen reduceras till cyklohexan, är ett exempel på hur raneynickel används i industrin. Det är överlag svårt att reducera bensenringens hexa-struktur. Raneynickel är en av många katalysatorer som klarar av detta men till exempel platinabaserade katalysatorer är mycket dyrare. Efter denna reaktion kan cyklohexan användas för syntes av adipinsyra, ett råmaterial vid industriell tillverkning av polyamider såsom nylon.[7]
Tillämpningar inom organisk syntes
Desulfurisering
Inom organisk syntes används raneynickel främst till desulfurisering. Till exempel kan tioacetaler reduceras till kolväten:[7]
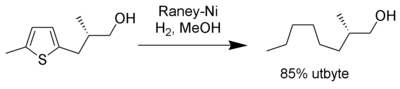
Tioler[8] och sulfider[9] kan avlägsnas från alifatiska, aromatiska eller heteroaromatiska föreningar. På samma sätt kan raneynickel avlägsna svavlet i tiofen vilket ger en mättad alkan.[10]
Reducering av funktionella grupper
Raneynickel används typiskt för att reducera föreningar med höga bindningstal (det vill säga föreningar med dubbel- eller trippelbindningar). Dessa kan vara alkyner, alkener,[11] nitriler[12], diener, aromater[13] och karbonylföreningar.
Dessutom kan raneynickel reducera bindningar mellan heteroatomer såsom hydraziner[14], nitrogrupper och nitrosaminer.[15] Katalysatorn kan också användas för reduktiv alkylering av aminer[16] och aminering av alkoholer.
Vid reduktion av kol-kol-dubbelbindningar kommer raneynickel att addera väte genom syn-addition.[7]
Säkerhet
På grund av dess stora yta och den stora mängd vätgas som den innehåller är torr och aktiverad raneynickel brandfarlig. Den bör alltid hanteras i en inert atmosfär. Raneynickel levereras vanligen som en 50-procentig slurry (suspension) i vatten. Raneynickel bör inte exponeras för luft, till och med efter reaktion innehåller den så mycket vätgas att den kan antändas i luft. Själva aktiveringen kan också frigöra stora mängder brandfarlig vätgas. Vid förbränning av raneynickel bildas farliga gaser, varför gasmask rekommenderas vid släckning av eld orsakad av katalysatorn. Dessutom kan inandning av raneynickel orsaka irritation i luftvägarna och leda till lungfibros. Förtärning kan orsaka kramper och tarmbesvär. Raneynickel kan också irritera huden och ögonen. Långvarig kontakt med raneynickel kan leda till lungsjukdomar eller nickelallergi. Raneynickel är möjligtvis även carcinogent och teratogent.[17]
Utveckling
Murray Raney erhöll en kandidatexamen inom maskinteknik från University of Kentucky 1909. 1915 började han arbeta inom oljeindustrin, bland annat med produktion av väte för hydrogenering av vegetabiliska oljor. På den tiden användes inom industrin en nickelkatalysator baserad på nickel(II)oxid. Då Raney trodde att det gick att tillverka bättre katalysatorer, började han 1921 självständigt forska om saken. 1924 producerades en Ni/Si-katalysator med förhållandet 1:1, och efter behandling med natriumhydroxid visade den sig vara fem gånger mera aktiv än dåtidens bästa katalysator för hydrogenering av bomullsfröolja. Denna katalysator patenterades i december 1925.[18] Raney tillverkade också en 1:1 Ni/Al-legering med en liknande process. Han upptäckte att denna katalysator var ännu aktivare och patenterade den 1926.[2] Samma 1:1-förhållande används än idag.
Efter att raneynickel hade utvecklats togs även andra legeringssystem i beaktande, till exempel med koppar, rutenium och kobolt. Vidare forskning visade att tillsats av en liten mängd av en tredje metall kunde höja den katalytiska aktiviteten. Dessa så kallade promotorer kan vara bland annat zink, molybden eller krom. På senare tid har en metod för att tillverka enantioselektiv raneynickel genom ytadsorption av vinsyra utvecklats.[19]
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, tidigare version.
Noter
- ^ Nationalencyklopedin: Raneynickel
- ^ [a b] Raney, Murray (1927). "Method of producing Finely Divided Nickel Arkiverad 25 februari 2006 hämtat från the Wayback Machine.". US Patent 1628190, utgivet 10 april 1927.
- ^ [a b c d e f g] Ertl, Gerhard; Knözinger, Helmut (Eds.) (1997). Preparation of Solid Catalysts, Weinheim: Wiley. ISBN 3-527-29826-6
- ^ [a b] A.J. Smith och D.L. Trimm (2005). Annual Reviews in Materials Research, 35, 127–142.
- ^ Hauptmann, H.; Walter, W. F. Chem. Rev. 1962, 62, 347. (Review)
- ^ Organic Syntheses (2005). Raney nickel usage in Organic Syntheses Arkiverad 5 juni 2009 hämtat från the Wayback Machine.. Hämtad 25 januari 2006.
- ^ [a b c] Solomons, T.W. Graham; Fryhle, Craig B. (2004). Organic Chemistry (8th Edn.), Wiley International Edition. ISBN 0-471-41799-8
- ^ Graham, A. R.; Millidge, A. F.; Young, D. P. J. Chem. Soc. 1954, 2180.
- ^ ^ Gassman, P. G.; van Bergen, T. J. (1988). "Indoles from anilines: Ethyl 2-methylindole-5-carboxylate". Org. Synth.; Coll. Vol. 6: 601.
- ^ Högsberg, H. E.; Hedenström, E.; Fägerhag, J.; Servi, S. J. Org. Chem. 1992, 57, 2052.
- ^ Page, G. A.; Tarbell, D. S. (1963). "β-(o-Carboxyphenyl)propionic acid". Org. Synth.; Coll. Vol. 4.
- ^ Robinson, Jr., H. C.; Snyder, H. R. (1955). "β-Phenylethylamine". Org. Synth.; Coll. Vol. 3: 720
- ^ (1955): "γ-n-Propylbutyrolactone and β-(Tetrahydrofuryl)propionic acid". Org. Synth.; Coll. Vol. 3: 742
- ^ Alexakis, A.; Lensen, N. Mangeney, P. Synlett 1992, 3, 625.
- ^ Enders, D.; Pieter, R.; Renger, B.; Seebach, D. (1988). "Nucleophilic α-sec-aminoalkylation: 2-(diphenylhydroxymethyl)pyrrolidene". Org. Synth.; Coll. Vol. 6: 542
- ^ Rice, R. G.; Kohn, E. J. (1963). "N,N'-Diethylbenzidene". Org. Synth.; Coll. Vol. 4: 283.
- ^ Electronic Space Products International (1994). Nickel aluminide Arkiverad 29 september 2007 hämtat från the Wayback Machine. MSDS. Läst 25 januari 2006.
- ^ Raney, Murray (1925). "Method of Preparing Catalytic Material Arkiverad 25 februari 2006 hämtat från the Wayback Machine.". US Patent 1563587, utgivet 1 december 1925. (Raneys ursprungliga nickel-kisel katalysator)
- ^ Bakker, M. L.; Young D. J.; Wainwright, M. S. J. (1988). Mat. Sci. 23, 3921.
Media som används på denna webbplats
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Författare/Upphovsman: FiskerDK, Licens: CC BY-SA 3.0
SEM of Raney nickel catalyst in which crystals of 1-50µm is seen.
Författare/Upphovsman: en:User:Rune.welsh, Licens: CC BY-SA 3.0
A sealed container used for storing a bottle of activated Raney nickel.
Reaction Thiophene over Raney Nickel
W3C-validity not checked.
Desulfurisering av tioacetal med Raneynickel
Författare/Upphovsman: User Rune.welsh on en.wikipedia, Licens: CC BY-SA 3.0
Sammanfattning
Reduktion av bensen till cyklohexan
Författare/Upphovsman: FiskerDK, Licens: CC BY-SA 3.0
A close-up of Raney nickel. Small cracks of approximately 1-100 nm width are seen within the crystals, causing the increased surface area.
(c) Rune.welsh, CC BY-SA 3.0
Dry Raney Nickel taken inside a glovebox under nitrogen atmosphere.