Natriumkromat
| Natriumkromat | |
  | |
| Systematiskt namn | Natrium(I)kromat |
|---|---|
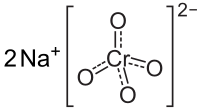
| Kemisk formel | Na2CrO4 |
| Molmassa | 161,973 g/mol |
| Utseende | Gula kristaller |
| CAS-nummer | 7775-11-3 |
| SMILES | [Na+].[Na+].[O-][Cr](=O)(=O)[O-] |
| Egenskaper | |
| Densitet | 2,72 g/cm³ |
| Löslighet (vatten) | 31,8 g/100 ml (0 °C) 84,5 g/100 ml (25 °C) 126,7 g/100 ml (100 °C) g/l |
| Smältpunkt | 792 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 136 mg/kg |
| SI-enheter & STP används om ej annat angivits | |
Natriumkromat är en jonförening (salt) av natrium och kromsyra med formeln Na2CrO4. Det uppträder som ett gult hygroskopiskt fast ämne, som kan bilda tetra-, hexa- och decahydrater och är en mellanprodukt vid utvinning av krom från dess malmer.
Framställning
Natriumkromat erhålls i stor skala genom rostning av krommalmer i luft i närvaro av natriumkarbonat:
- 2Cr2O3 + 4 Na2CO3 + 3 O2 → 4 Na2CrO4 + 4 CO2
Denna process omvandlar kromet till en vattenextraherbar form och lämnar järnoxider. Vanligtvis ingår kalciumkarbonat i blandningen för att förbättra syreåtkomsten och för att hålla kisel- och aluminiumföroreningar i olöslig form. Processtemperaturen är vanligtvis cirka 1 100 °C.[1] För laboratorie- och småskaliga preparat kan en blandning av kromitmalm, natriumhydroxid och natriumnitrat som reagerar vid lägre temperaturer användas (till och med 350 °C i motsvarande kaliumkromatsystem).[2] Efter bildandet omvandlas kromatsaltet till natriumdikromat, föregångaren till de flesta kromföreningar och material.[3] Den industriella vägen till krom(III)oxid innebär reduktion av natriumkromat med svavel.
Natriumkromat kan också utvinnas ur kromit-malm genom att behandla den med natriumkarbonat (Na2CO3).
Syra-bas-beteende
Natriumkromat omvandlas till natriumdikromat när det behandlas med syror:
- 2 Na2CrO4 + 2HCl → Na2Cr2O7 + 2NaCl + H2O
Ytterligare försurning ger kromtrioxid:
- Na2CrO4 + H2SO4 → CrO3 + Na2SO4 + H2O
Användning
Bortsett från dess centrala roll i produktionen av krom från dess malmer används natriumkromat som en korrosionsinhibitor i petroleumindustrin.[3] Det är också ett färgningshjälpmedel inom textilindustrin[3] och ett diagnostiskt hjälpmedel för att bestämma volym av röda blodkroppar.[4]
I organisk kemi används natriumkromat som en oxidant, som omvandlar primära alkoholer till karboxylsyror och sekundära alkoholer till ketoner.[5] Natriumkromat är ett starkt oxidationsmedel.
Säkerhet
Som med andra Cr (VI) -föreningar är natriumkromat cancerframkallande.[6] Föreningen är också frätande och exponering kan ge allvarliga ögonskador eller blindhet.[7] Exponering av människor omfattar vidare nedsatt fertilitet, ärftliga genetiska skador och skador på ofödda barn.
Se även
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Sodium chromate, 27 oktober 2022.
Noter
- ^ IARC Monographs 49 Ch. 2. ISBN 9789283212492. https://monographs.iarc.fr/ENG/Monographs/vol49/mono49-6B.pdf.
- ^ Zhi Sun, Yi Zhang, Shi-Li Zheng, Yang Zhang (2009). ”A new method of potassium chromate production from chromite and KOH-KNO3-H2O binary submolten salt system”. AIChE Journal 55 (10): sid. 2646–2656. doi:.
- ^ [a b c] Gerd Anger, Jost Halstenberg, Klaus Hochgeschwender, Christoph Scherhag, Ulrich Korallus, Herbert Knopf, Peter Schmidt, Manfred Ohlinger. "Chromium Compounds". Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH. doi:10.1002/14356007.a07_067.
- ^ Bracco Diagnostics Inc.. ”chromitope sodium (Sodium Chromate, Cr 51) injection, solution”. DailyMed. http://dailymed.nlm.nih.gov/dailymed/drugInfo.cfm?id=6525. Läst 20 juni 2008.
- ^ Louis F. Fieser "Δ4-cholesten-3,6-dione" Org. Synth. 1955, 35, 36. doi:10.15227/orgsyn.035.0036
- ^ IARC (2012). Volume 100C: Arsenic, Metals, Fibres, and Dusts. Lyon: International Agency for Research on Cancer. ISBN 978-92-832-0135-9. https://publications.iarc.fr/_publications/media/download/3026/50ed50733f7d1152d91b30a803619022ef098d59.pdf. Läst 5 januari 2020. ”There is sufficient evidence in humans for the carcinogenicity of chromium (VI) compounds. Chromium (VI) compounds cause cancer of the lung. Also positive associations have been observed between exposure to Chromium (VI) compounds and cancer of the nose and nasal sinuses. There is sufficient evidence in experimental animals for the carcinogenicity of chromium (VI) compounds. Chromium (VI) compounds are carcinogenic to humans (Group 1).” Arkiverad 17 mars 2020 hämtat från the Wayback Machine. ”Arkiverade kopian”. Arkiverad från originalet den 17 mars 2020. https://web.archive.org/web/20200317095517/https://publications.iarc.fr/_publications/media/download/3026/50ed50733f7d1152d91b30a803619022ef098d59.pdf. Läst 7 januari 2023.
- ^ ”Potassium dichromate MSDS”. JT Baker. http://hazard.com/msds/mf/baker/baker/files/p5719.htm.
Vidare läsning
- ”Sodium chromate”. inchem. http://www.inchem.org/documents/icsc/icsc/eics1370.htm. Läst 20 juni 2008.
- Sodium chromate i substansdatabasen GESTIS-Stoffdatenbank hos IFA (Institut für Arbeitsschutz der Deutschen Gesetzlichen Unfallversicherung). (JavaScript krävs)
Externa länkar
 Wikimedia Commons har media som rör Natriumkromat.
Wikimedia Commons har media som rör Natriumkromat.
Media som används på denna webbplats
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Symbol of pollutants to the environment, according to the directive 67/548/EWG of 'European Chemicals Bureau (European Chemicals Agency).
Sodium chromate, Na2CrO4
The hazard symbol for highly toxic substances according to directive 67/548/EWG by the European Chemicals Bureau.
Natriumkromat, strukturformel






