Molekylorbital
| Den här artikeln behöver källhänvisningar för att kunna verifieras. (2020-01) Åtgärda genom att lägga till pålitliga källor (gärna som fotnoter). Uppgifter utan källhänvisning kan ifrågasättas och tas bort utan att det behöver diskuteras på diskussionssidan. |
En molekylorbital är en orbital som kan användas för att beskriva elektronmolnet i en molekyl. Molekylorbitaler konstrueras av atomorbitaler och används för att beskriva kemiska bindningar. Skillnaden i energinivå mellan molekylorbitalerna och de högsta individuella orbitalerna runt varje ingående atom (de som bildar bindningen) avgör bindningsstyrkan.
Bindande och antibindande orbitaler
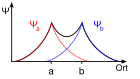
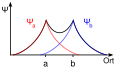
När en atom kommer i närheten av en annan atom, påverkas elektronernas energinivåer. Nya orbitaler uppstår genom kombinationer av atomorbitaler, men deras totala antal ändras inte. Det enklaste fallet är vätemolekylen, H2. Som första approximation betraktar man endast atomernas 1s-orbitaler, Ψa och Ψb. Varje väteatomorbital innehåller en elektron, och de kombineras till en bindande molekylorbital, med två elektroner, och en tom antibindande molekylorbital. I de bindande överlappar p orbitalerna och har samma tecken, i de antibindande överlappar p orbitalerna med motsatt tecken.
Antibindande molekylorbitaler, som man brukar ange med en asterisk, har ett nodplan vinkelrätt mot bindningens axel.
Sigma-, pi- och delta-orbitaler
Molekylorbitaler kan indelas efter antalet nodplan: sigma-orbitaler saknar nodplan, pi-orbitaler har ett nodplan och delta-orbitaler har två nodplan parallellt med bindningen. Sigma-orbitaler ger det starkaste bidraget till den kemiska bindningen, eftersom de har en stor elektronkoncentration mellan de positivt laddade atomkärnorna.
HOMO och LUMO
Den orbital med högst energi som har elektroner i sig brukar kallas HOMO (Highest Occupied Molecular Orbital). Den tomma orbital som har lägst energi brukar kallas LUMO (Lowest Unoccupied Molecular Orbital). Kemiska reaktioner mellan molekyler kan beskrivas som interaktioner mellan HOMO på en molekyl och LUMO på en annan molekyl.
Se även
Externa länkar
 Wikimedia Commons har media som rör Molekylorbital.
Wikimedia Commons har media som rör Molekylorbital.
Media som används på denna webbplats
Författare/Upphovsman: Tkgd2007, Licens: CC BY-SA 3.0
A new incarnation of Image:Question_book-3.svg, which was uploaded by user AzaToth. This file is available on the English version of Wikipedia under the filename en:Image:Question book-new.svg
Additive superposition of wave functions
Subtractive superposition of wave functions
The 1s σ* antibonding molecular orbital of the dihydrogen molecule, H2
Författare/Upphovsman: Helvet, Licens: CC BY-SA 4.0
H2 antibonding orbital