Magnesiumkarbonat
| Magnesiumkarbonat | |
 | |
| Systematiskt namn | Magnesiumkarbonat |
|---|---|
| Övriga namn | Magnesit |
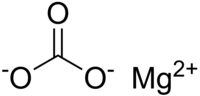
| Kemisk formel | MgCO3 |
| Molmassa | 84,3139 g/mol |
| Utseende | Vita kristaller |
| CAS-nummer | 546-93-0 |
| SMILES | [O-]C(=O)[O-].[Mg+2] |
| Egenskaper | |
| Densitet | 2,958 g/cm³ |
| Löslighet (vatten) | 0,106 g/l (20 °C) |
| Smältpunkt | 540 °C (sönderfaller) |
| SI-enheter & STP används om ej annat angivits | |
Magnesiumkarbonat, MgCO3, förekommer i naturen under benämningen magnesit. Trivialnamnet är magnesia, vilket emellertid är tvetydigt, eftersom även magnesiumoxid kallas magnesia.
Egenskaper
Magnesit liknar mycket kalkspat och kristalliserar i samma former, men har något större specifik vikt och hårdhet enligt Mohs 4 – 4,5. Vidare angrips den av syror först vid uppvärmning. Den är vit, ofta gulaktig eller grå till färgen till följd av inblandningar, särskilt av järnkarbonat m m.[1]
Vid höga temperaturer sönderfaller magnesiumkarbonat till magnesiumoxid och koldioxid. Processen kallas kalcinering.
Förekomst
Magnesit bildar här och var mäktiga lager. I Kanada och Kalifornien förekommer den i vidsträckta lager tillsammans med serpentin, liksom i Schlesien, Tjeckien och Ungern, samt i Norrbotten (vid Kvikkjokk). Den förekommer även tillsammans med talkskiffer och lerskiffer.[1]
En speciellt tät magnesit, kallad bosniskt sjöskum, förekommer på Balkan och används för tillverkning av piphuvuden. [1]
På konstgjord väg tillverkas magnesiumkarbonat och basiskt magnesiumkarbonat.[1]
Användning
- Inom livsmedelsindustrin som klumpförebyggande medel; har E-nummer 504.
- Inom sporter som till exempel bergsklättring, gymnastik och tyngdlyftning för att ta bort fukt från händerna, och därigenom öka greppförmågan.
En magnesiumkarbonatmolekyl kan tillsammans med 3 eller 5 vattenmolekyler bilda en saltkristall. På så vis torkas händerna ut. Inom sport kallas magnesiumkarbonat oftast för krita trots att det inte alls är krita (kalciumkarbonat, CaCO3) som helt saknar förmågan att binda vatten. Det är heller inte talk, som används för att minska friktionen. - Framställning av magnesiumoxid
- Framställning av olika golvmassor
- Framställning av Magnesiacement.[2]
- Beståndsdel i eldfast tegel
Källor
- ^ [a b c d] Meyers varulexikon, Forum, 1952
- ^ Carlquist, Gunnar, red (1937). Svensk uppslagsbok. Bd 17. Malmö: Svensk Uppslagsbok AB. sid. 1202
Media som används på denna webbplats
chemical structure of magnesium carbonate
