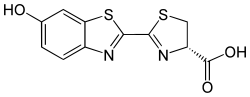
Luciferin

Luciferiner (latin lucifer, "ljusbringare") är en klass av heterocykliska föreningar som alstrar ljus och som återfinns i bioluminiscenta (ljusalstrande) organismer. Luciferiner undergår i typiska fall en enzymkatalyserad oxidation och återgår därefter omedelbart till ursprungstillståndet under utsändande av ljus. Termen "luciferin" används i allmänhet både för molekyler som reagerar med enzymer (kallade luciferaser) för att alstra ljus och för fotoproteiner som sänder ut ljus utan medverkan av enzym.[1]
Typer
Luciferiner är en klass av små substratmolekyler som oxideras i närvaro av ett luciferas-enzym och därvid bildar oxiluciferin, som när det spontant återbildas till luciferin sänder ut ljus. Det finns många typer av luciferiner (hur många är inte känt, men några av de mera utförligt studerade återfinns nedan), men alla har de användandet av reaktiva syreföreningar för att alstra ljus gemensamt.[2]
Insekter
Bioluminiscens finns hos många arter insekter. De mest välkända är skalbaggar av bl.a. familjerna lysmaskar och knäppare (bioluminiscenta arter av dessa familjer kallas ofta eldflugor), men det finns även hoppstjärtar, tvåvingar och skinnbaggar som har denna typ av luciferin. Små skillnader i luciferinets struktur mellan olika arter gör att ljuset varierar från grönt (530 nm) till rött (635 nm). Vid reaktionen oxideras (hos Photinus pyralis) substratet D-Luciferin (LH2), en benzotiazol, med hjälp av ett luciferas av syre. William D. McElroy visade i slutet av 1940-talet att ATP förbrukas (vilket är notabelt)[3] och kräver närvaro av magnesiumjoner som kofaktor, enligt:[4]
Snäckor
Den nyzeeländska sötvattenssnäckan Latia neritoides, det enda kända bioluminiscenta blötdjuret i sötvatten,[5] har ett luciferin som är en terpenoid aldehyd. För reaktionen mellan luciferin, luciferas och molkylärt syre krävs även en kofaktor som är ett purpurfärgat protein. Vid reaktionen bildas även myrsyra:
Bakterier
Bakterieluciferin återfinns hos bakterier. Somliga bioluminiscenta lever i symbios med vissa bläckfiskar och fiskar, framför allt djuphavsfiskar, i speciella lysorgan. Det består av en lång aldehydkedja och ett reducerat riboflavin-fosfat, flavinmononukleotid FMNH2. I reaktionen ombildas en aldehyd till en karboxylsyra, enligt:
Dinoflagellater
Hos dinoflagellater förekommer ett luciferin som är en tetrapyrrol som liknar klorofyll och som åstadkommer ett blågrönt ljus. Dessa organismer orsakar ofta mareld. Ett nästan identiskt luciferin (ett väte är ersatt av en OH-grupp) finns hos lysräkor.
Vargulin
Vargulin förekommer hos vissa musselkräftor och hos paddfiskar av släktet Porichtys. Liksom coelenterazin är det en imidazopyrazinon och utsänder huvudsakligen blått ljus hos dessa djur.
Coelenterazin
Coelenterazin återfinns hos radiolarier, kammaneter, nässeldjur, bläckfiskar, pilmaskar, fiskar, och räkor. Det är prostetisk grupp i proteinet aekvorin som orsakar det blåa ljus dessa arter alstrar.[6] För att reaktionen skall äga rum krävs förutom luciferas och molekylärt syre även kalciumjoner.[7]
Watasenialuciferin
Hos den tioarmade bläckfisken Watasenia scintillans, som har talrika lysorgan över hela kroppen, återfinns ett disulfat av coelenterazin.[8] Det kräver förutom molekylärt syre även ATP och magnesiumjoner.[9]
Luciferin hos Diplocardia longa
Hos fåborstmasken Diplocardia longa förekommer en enkelt byggd aldehyd, N-Isovaleryl-3-aminopropanal. Detta luciferin är ovanligt eftersom det inte reagerar med molekylärt syre, som ju är normalfallet, utan med väteperoxid.[10]
Användningar
Eldflugeluciferinet kan användas för att påvisa ATP, då detta ju förbrukas vid oxidationen.[11] Detta reagens använder man inom livsmedelsindustrin för att påvisa bakterier, eftersom ATP endast förekommer hos levande organismer.[12]
Eftersom rektionen för aekvorin/coelenterazin kräver närvaro av kalciumjoner har detta använts för att mäta kalciumjonkoncentration.[13][14]
Luciferasgener sätts inom molekylärbiologin ofta in som markörer. Producerat luciferas kan sedan konstateras med motsvarande luciferin.[15][16][17]
Referenser
- ^ Hastings JW (1996). ”Chemistries and colors of bioluminescent reactions: a review”. Gene 173 (1 Spec No): sid. 5–11. doi:. PMID 8707056.
- ^ Hastings JW (1983). ”Biological diversity, chemical mechanisms, and the evolutionary origins of bioluminescent systems”. J. Mol. Evol. 19 (5): sid. 309–21. doi:. PMID 6358519.
- ^ Green A, McElroy WD (October 1956). ”Function of adenosine triphosphate in the activation of luciferin”. Arch. Biochem. Biophys. 64 (2): sid. 257–71. doi:. PMID 13363432.
- ^ Osamu Shimomura, a. a. O. S. 1ff.
- ^ Meyer-Rochow V. B. & Moore S. (1988) "Biology of Latia neritoides Gray 1850 (Gastropoda, Pulmonata, Basommatophora): the Only Light-producing Freshwater Snail in the World". Internationale Revue der gesamten Hydrobiologie und Hydrographie 73(1): 21-42. doi:10.1002/iroh.19880730104.
- ^ Shimomura O, Johnson FH (April 1975). ”Chemical nature of bioluminescence systems in coelenterates”. Proc. Natl. Acad. Sci. U.S.A. 72 (4): sid. 1546–9. doi:. PMID 236561.
- ^ Shimomura, O. und Johnson, FH. (1970): Calcium binding, quantum yield, and emitting molecule in aequorin bioluminescence, i Nature 227(5265); 1356–1357; PMID 4393938.
- ^ Inoue, S. et al. (1976): Squid bioluminescence III. Isolation and structure of Watasenia luciferin. In: Tetrahedron Lett. 17(34); 2971–2972; doi:10.1016/S0040-4039(01)85503-9
- ^ Tsuji, FI. (1985): ATP-dependent bioluminescence in the firefly squid, Watasenia scintillans. i Proc Natl Acad Sci USA 82(14); 4629–4632; PMID 16593580; PMC 390439.
- ^ Rudie, NG. et al. (1981): Earthworm bioluminescence: characterization of high specific activity Diplocardia longa luciferase and the reaction it catalyzes, in: Biochemistry 20 (2): 344–350; PMID 6258637.
- ^ Neufeld HA. et al. (1975): A rapid method for determining ATP by the firefly luciferin-luciferase system, in: Experientia 31 (3), 391–392; PMID 1116561.
- ^ Hawronskyj, J.-M. und Holah, J. (1997): ATP: a universal hygiene monitor. In: Trends Food Sci. Tech. 8; 79-84; doi:10.1016/S0924-2244(97)01009-1
- ^ Knight, MR. et al. (1991): Recombinant aequorin as a probe for cytosolic free Ca2+ in Escherichia coli, in: FEBS Lett. 282 (2); 405–408; PMID 2037058; PDF (freier Volltextzugriff, engl.)
- ^ Knight, MR. et al. (1991): Transgenic plant aequorin reports the effects of touch and cold-shock and elicitors on cytoplasmic calcium, in: Nature 352(6335); 524–526; PMID 1865907.
- ^ Hampf M, Gossen M: A protocol for combined Photinus and Renilla luciferase quantification compatible with protein assays. Anal Biochem. 2006 Sep 1;356(1):94-9. Epub 2006 May 12, Link: http://www.ncbi.nlm.nih.gov/pubmed/16750160
- ^ ”Arkiverade kopian”. Arkiverad från originalet den 6 september 2012. https://archive.is/20120906173718/http://www.pjk-gmbh.com/69.html. Läst 9 oktober 2012.
- ^ http://www.promega.com/products/reporter-assays-and-transfection/reporter-assays/dual_luciferase-reporter-assay-system/
Media som används på denna webbplats
general bioluminescence reaction of coelenterazines (Aequorea victoria coelenterazine: R1=phenol, R2= CH2-phenol, R3=benzyl)
Chemical diagram for reduced flavin mononucleotide (FMNH2)
structure of the firefly luciferin
Coelenterazine
Latia-Luciferin