Kemiteknik

Kemiteknik är tillämpningen av kunskaper inom kemi, ofta tillsammans med kunskaper inom områden såsom livsvetenskap, biologi, mikrobiologi, fysik och matematik, för att finna tekniska lösningar på problem. Detta innefattar omvandling av råvaror eller kemikalier till mer användbara och värdefulla produkter, men innefattar även framtagande av nya material och tekniker – såsom nanoteknik, bränsleceller och biomedicinsk teknik. Kemitekniken är även en del av teknologi och en sorts ingenjörskonst. Högst centralt inom kemitekniken är även utrustningen som används, till exempel för analys eller framtagning. Kemiteknik innefattar även till stor del design, optimering och underhåll av biologiska och kemiska processer vid storskalig produktion. En av de huvudsakliga uppgifterna för en kemiingenjör är att se till att processen sker säkert, hållbart och ekonomiskt.
Det finns ett stort överlapp mellan kemiteknik och flera andra ämnesområden inom ingenjörsvetenskapen, såsom bioteknik, energiteknik, materialteknik, metallurgi och miljöteknik.
En person utbildad inom kemiteknik brukar betecknas kemiingenjör. Flera av Sveriges tekniska högskolor bedriver både civil- och högskoleingenjörsutbildning i kemiteknik.
Kemiteknikens historia
Kemitekniken har existerat som en egen gren av teknologi i lite över hundra år[1]. Den uppstod först som en avgrening till den vanliga mekaniken då man under 1800-talet behövde kemiska processorer för vissa processer, där mekaniken inte längre räckte till. På den tiden använde man fortfarande så kallade batchprocesser för att producera kemikalier och andra eftertraktade produkter.
I en batchprocess tillsätter man alla ingredienser i ett kärl vid processens start, varpå man får dessa att reagera genom uppvärmning eller tryckökning, tills produkten är framställd. Då denna typ av framställning krävde att man efter varje batch renade kärlet som reaktionen hade skett i och att man sedan åter igen var tvungen att tillsätta alla ingredienser var det en tidskrävande process. En fördel med framställning genom batchprocess, speciellt då mikroorganismer är involverade, är att kontaminationsrisken är liten då man aldrig öppnar kärlet under körning, dock är batchprocessen sällan lika effektiv som andra processtyper. Idag sker framställningen ofta mer automatiserat, utan behov av att ladda om kärlet inför varje ny körning. De flesta kemikalier produceras alltså idag genom en kombination av flera steg som utförs i följd efter varandra.
Det var huvudsakligen under den industriella revolutionen som batchprocessen byttes ut mot automatiserade processer.
Efterfrågan på kemikalier, kemiteknikens uppkomst
Svavelsyra H2SO4
Med starten av den industriella revolutionen ökade behovet av specifika kemikalier som till stor del var vitala för industrins fortsatta tillväxt. Den mest eftertraktade var svavelsyra[2]. Svavelsyra (H2SO4) är, som hörs på namnet, en syra. Det speciella med just denna syra är hur den reagerar med många metaller såsom järn, aluminium, zink, mangan, magnesium, nickel, koppar och tenn.[3].
Exempelreaktion med järn:
Svavelsyra reagerar, enligt reaktionen ovan, med metaller för att producera vätgas (H2) och ett salt i form av metallens sulfat (MeSO4). Denna reaktion gör att metallen i fråga kan separeras ur malm, i sin sulfatform, för att sedan återskapas till den ursprungliga metallen[4]. Denna egenskap hos svavelsyra gjorde den väldigt värdefull för metallutvinning samtidigt som den används för behandling av avloppssvatten och oljeraffinering.
Natriumkarbonat Na2CO3 och Kaliumkarbonat K2CO3
Ytterligare kemikalier vars efterfrågan ökade runt samma tid är natriumkarbonat (även kallad kalcinerad soda eller enbart soda) och även kaliumkarbonat (även kallad pottaska). Dessa båda används till bland annat glas, tvål och textil varför de var högt eftertraktade runt denna tid. Ämnena framställdes huvudsakligen från träd men den kraftiga efterfrågan resulterade i att träden blev färre. Detta var ett stort problem bl.a. i England där man var tvungen att byta källa till sjögräs, att importera utifrån landet ansågs för dyrt[5].
Snart uppfanns en ny metod för att utvinna dessa kemikalier, denna gång ur vanligt salt. Metoden uppfanns av Nicholas Leblanc varför processen blev känd som Leblanc-processen. Tyvärr skapade processen många negativa biprodukter - saltsyra, kväveoxider, svavel, klorgas samt mangan.
År 1861 kom äntligen en ny process som kunde byta ut den skadliga Leblanc-processen, Solvay-processen. Jämfört med Leblanc var detta en betydligt mer komplex process, kemin bakom den var enklare än den för Leblanc. Själva kemin bakom processen uppfanns redan 1811, det var huvudsakligen uppskalningen som var problemet. Först när Ernest Solvay lyckats med uppskalningen blev processen användbar. Solvays bidrag var därav enbart kemitekniken bakom processen, inte kemin i sig självt. Samtidigt var denna nya processen termodynamiskt ogynnsamt, dvs. den vill egentligen inte ske utan vill hellre skapa reaktanter av produkterna (reaktionen vill ske åt andra hållet än pilen pekar, se nedan).
Dessa två processer demonstrerar utmärkt kemiteknikens utveckling. Samtidigt som Leblanc-processen var en batchprocess med oönskade biprodukter var solvay-processen en innovativ kontinuerlig process som eliminerade oönskade biprodukter och dessutom producerade en enklare att rena fram.
Solvay-processen involverade flera höga torn utrustade med bafflar för maximal omrörning, där varje ton hade en specifik uppgift i processen. Först tillfördes saltvatten till ett ammoniak torn, där saltvattnet får reagera med ammoniak. Därefter tillförs koldioxid till saltvatten-ammoniak-blandningen vilket resulterar i att NaHCO3 faller ur blandningen. Slutligen renar man ut utfällningen och låter denna reagera med kalciumoxid (CaO) för att ge den färdiga produkten. Genomgående för hela processen är att de flesta kemikalier som använts återanvänds och väldigt lite förbrukas.[6].
Kemiteknikens födelse
Solvay-processen var ett stort steg i rätt riktning för kemitekniken. Genom Solvay-processen hade man lyckats revolutionera en tidigare naturskadlig process och gjort den inte bara snällare mot naturen, utan även mer effektiv. Då dessa saker i retrospektiv är uppenbara milstolpar i kemiteknikens historia, fanns det ännu inget som direkt kallades för kemiteknik. Ingenstans kunde man undervisas i denna nya disciplin, och ämnet hade ännu inte separerat sig vanlig ingenjörsvetenskap.
Två huvudsakliga personer tog kemitekniken och gjorde det till en accepterad, individuell, vetenskap. Den första av dessa två är George E. Davis.
George Davis var en kemist till yrket och arbetade mycket med att inspektera diverse natriumkarbonat anläggningar. Här fick han ofta undersöka processer såsom Leblanc och Solvay, processer som George ansåg i sin utveckling undergått sådana revolutionerande förändringar att de förtjänade en egen gren av ingenjörsvetenskap - kemiteknik. År 1887 skapade han 12 välkända lektioner, innehållande all hans kemitekniska kunskap om just kemiteknik (chemical engineering på engelska) som han erbjöd på Manchester Technical School[7]. Här beskrev han diverse kemiska operationer införde kemiska eller fysikaliska förändringar i materialet, som senare kom att bli kallade för enhetsoperationer. Med dessa undervisningar hade en ny ingenjörsinriktning föds.
Den andra personen, som i princip sett gjorde det George Davis gjort i England fast i USA, var Lewis Norton. Lewis Norton var en professor i kemi på Massachusetts Institute of Technology (MIT) som, bara några månader efter George Davis lektioner, började erbjuda den första kandidatutbildningen inom kemiteknik[8].
Dessa två händelser resulterade i att fler och fler universitet och högskolor började erbjuda kurser och utbildningar inom den nya disciplinen kemiteknik, och snart var kemiteknik en etablerad teknologinriktning.
Kemi och Innovation

Kemi och innovation inom kemi är nära länkade till samhället och dess utveckling. I allting från mat, kläder och datorkomponenter används kemi och kunskap kring kemi. Medicin, bensin och skrivpapper är alla resultat av kemiforskning och mycket mer därtill. Många av nutidens största problem, global uppvärmning och vattenbrist i fattiga länder, är problem som till stor del kan lösas genom tillämpning av kemi- ,fysik- och biologikunskap. För att motverka den globala uppvärmningen krävs nya innovativa energilösningar som kan ersätta vår ofantliga användning av fossila bränslen. Många potentiella substitut till fossila bränslen existerar - solceller, vätgasreaktorer, eller fusionsreaktorer är några alternativ. Majoriteten av de föreslagna lösningarna har deras nära anknytning till kemi gemensamt[9].
Se även
Referenser
- ^ W. F. Furter (1982) A Century of Chemical Engineering. New York: Plenum Press.
- ^ The story – Early Industrial Industry
- ^ Wikipedia, Sulfuric Acid – Chemical Properties
- ^ Copper Mining Information
- ^ History of CheEn: Setting the Stage
- ^ Wikipedia, Chemistry of the Solvay Process.
- ^ George Davis
- ^ History, Chemical Engineering department, MIT
- ^ P&K, "Kemin är överallt" Arkiverad 26 september 2011 hämtat från the Wayback Machine.
|
Media som används på denna webbplats
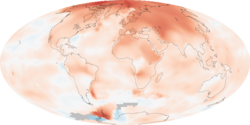
The map illustrates just how much warmer temperatures were in the decade (2000-2009) compared to average temperatures recorded between 1951 and 1980 (a common reference period for climate studies). The most extreme warming, shown in red, was in the Arctic. Very few areas saw cooler than average temperatures, shown in blue. Gray areas over parts of the Southern Ocean are places where temperatures were not recorded. The analysis, conducted by the Goddard Institute for Space Studies (GISS) in New York City, is based on temperatures recorded at meteorological (weather) stations around the world and satellite data over the oceans.
- For temperature palette, see GISS temperature palette.svg.
Författare/Upphovsman: User:Luigi Chiesa, Licens: CC BY 3.0
A double effect distillation plant.


