Karnitin
| Karnitin | |
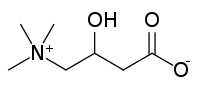  | |
| Systematiskt namn | 3-hydroxi-4-(trimetylazaniumyl)butanat |
|---|---|
| Kemisk formel | C7H15SO4 |
| Molmassa | 101,201 g/mol |
| Utseende | Vitt pulver |
| CAS-nummer | 406-76-8 |
| SMILES | C[N+](C)(C)CC(CC(=O)[O-])O |
| Löslighet (vatten) | Vattenlösligt |
| SI-enheter & STP används om ej annat angivits | |
Karnitin är en transportmolekyl som är nödvändig för metabolismen av fettsyror. En källa till karnitin är kött, men karnitin kan även egensyntetiseras från aminosyrorna lysin och metionin. Karnitin är en kvartär ammoniumförening involverad i ämnesomsättningen i de flesta däggdjur, växter och vissa bakterier.[1][2][3][4]Som stöd för energiomsättningen transporterar karnitin långkedjiga fettsyror från cytosolen till mitokondrier för att oxideras för fri energiproduktion, och deltar också i att ta bort metabolismprodukter från celler.[3] Med tanke på dess viktiga metaboliska roller, är karnitin koncentrerat i vävnader som skelett och hjärtmuskulatur som metaboliserar fettsyror som en energikälla.[3] I allmänhet syntetiserar individer, inklusive strikta vegetarianer, tillräckligt med L-karnitin in vivo.[1]
Karnitin existerar som en av två stereoisomerer. De två enantiomererna d-karnitin (S-(+)-) och l-karnitin (R-(−)-).[5] Båda är biologiskt aktiva, men endast l-karnitin förekommer naturligt hos djur, och d-karnitin är giftigt eftersom det hämmar aktiviteten av l-formen.[6] Vid rumstemperatur är rent karnitin ett vitaktigt pulver och en vattenlöslig zwitterjon med relativt låg toxicitet. Härledd från aminosyror,[7] extraherades karnitin först från köttextrakt 1905, vilket ledde till dess namn från latin, "caro/carnis" eller kött.[2]
Vissa individer med genetiska eller medicinska störningar (som för tidigt födda barn) kan inte tillverka tillräckligt med karnitin, vilket kräver kosttillskott.[1][3][4] Trots vanlig karnitintillskottskonsumtion bland idrottare för förbättrad träningsprestation eller återhämtning, finns det otillräckligt högkvalitativt kliniskt bevis för att belägga att det ger någon fördel.[3][4]
Biosyntes och metabolism

Många eukaryoter, inklusive människor, har förmågan att syntetisera karnitin.[1][3] Människor syntetiserar karnitin från substratet TML (6-N-trimetyllysin), som i sin tur härrör från metyleringen av aminosyran lysin.[1] TML hydroxyleras sedan till hydroxitrimetyllysin (HTML) med trimetyllysindioxygenas (TMLD), vilket kräver närvaro av askorbinsyra och järn. HTML klyvs sedan av HTML-aldolas (HTMLA, ett pyridoxalfosfat som kräver enzym), vilket ger 4-trimetylaminobutyraldehyd (TMABA) och glycin. TMABA dehydreras därefter till gamma-butyrobetain i en NAD+-beroende reaktion, katalyserad av TMABA-dehydrogenas.[1] Gamma-butyrobetain hydroxyleras sedan av gamma-butyrobetain-hydroxylas (ett zinkbindande enzym[8]) till l-karnitin, vilket kräver järn i form av Fe2+.[1][9]
Karnitin är involverat i transport av fettsyror över mitokondriella membranet, genom att bilda en långkedjig acetylkarnitinester och transporteras av karnitinpalmitoyltransferas I och karnitinpalmitoyltransferas II.[10] Karnitin spelar också en roll för att stabilisera nivåerna av acetyl-CoA och koenzym A genom förmågan att ta emot eller avge en acetylgrupp.[1]
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Carnitine, 3 januari 2024.
- ^ [a b c d e f g h] ”L-Carnitine”. Micronutrient Information Center, Linus Pauling Institute, Oregon State University, Corvallis, OR. 1 december 2019. https://lpi.oregonstate.edu/mic/dietary-factors/L-carnitine. Läst 29 april 2020.
- ^ [a b] Bremer J (Oktober 1983). ”Carnitine – metabolism and functions”. Physiological Reviews 63 (4): sid. 1420–80. doi:. PMID 6361812.
- ^ [a b c d e f] ”Carnitine”. Office of Dietary Supplements, US National Institutes of Health. 10 oktober 2017. https://ods.od.nih.gov/factsheets/Carnitine-HealthProfessional/. Läst 29 april 2020.
- ^ [a b c] ”L-carnitine: Uses, benefits and dosage”. Drugs.com. 20 januari 2020. https://www.drugs.com/npp/l-carnitine.html. Läst 29 april 2020.
- ^ ”Levocarnitine”. PubChem, National Library of Medicine, US National Institutes of Health. 25 april 2020. https://pubchem.ncbi.nlm.nih.gov/compound/10917. Läst 29 april 2020.
- ^ Matsuoka M, Igisu H (Juli 1993). ”Comparison of the effects of L-carnitine, D-carnitine and acetyl-L-carnitine on the neurotoxicity of ammonia”. Biochemical Pharmacology 46 (1): sid. 159–64. doi:. PMID 8347126.
- ^ Cox RA, Hoppel CL (December 1973). ”Biosynthesis of carnitine and 4-N-trimethylaminobutyrate from 6-N-trimethyl-lysine”. The Biochemical Journal 136 (4): sid. 1083–90. doi:. PMID 4786530.
- ^ Tars K, Rumnieks J, Zeltins A, Kazaks A, Kotelovica S, Leonciks A, Sharipo J, Viksna A, Kuka J, Liepinsh E, Dambrova M (Augusti 2010). ”Crystal structure of human gamma-butyrobetaine hydroxylase”. Biochemical and Biophysical Research Communications 398 (4): sid. 634–9. doi:. PMID 20599753.
- ^ Strijbis K, Vaz FM, Distel B (Maj 2010). ”Enzymology of the carnitine biosynthesis pathway”. IUBMB Life 62 (5): sid. 357–62. doi:. PMID 20306513.
- ^ Flanagan JL, Simmons PA, Vehige J, Willcox MD, Garrett Q (April 2010). ”Role of carnitine in disease”. Nutrition & Metabolism 7: sid. 30. doi:. PMID 20398344.
|
Media som används på denna webbplats
Författare/Upphovsman: Manuel Almagro Rivas, Licens: CC BY-SA 4.0
Ball-and-stick model of an (S)-carnitine molecule. Structure obtained using X-ray diffraction. Original paper: Ng, S. (2012). ( R )-(3-Carboxy-2-hydroxypropyl)trimethylazanium chloride. Acta Cryst E, 68(5), pp.o1416-o1416. doi: 10.1107/S160053681201598X Image created with Avogadro, Discovery Studio 4.5 and GIMP 2.
Chemical structure of carnitine
Endogenous biosynthesis of L-Carnitine from protein-bound amino-acids


