Karboransyra
| Karboransyra | |
![Molekylmodell av [CHB11Cl11]−. (Sur proton visas inte). Färgschema: väte − vit, klor − grön, bor − rosa, kol − svart.](http://upload.wikimedia.org/wikipedia/commons/thumb/7/76/Carborane-acid-3D-balls.png/200px-Carborane-acid-3D-balls.png) | |
| SMILES | [H].[CH]1234[B]([Cl])56%10[B]([Cl])17%11[B]([Cl])28%12[B]([Cl])39%13[B]([Cl])415[B]([Cl])620[B]([Cl])37%10[B]([Cl])48%11[B]([Cl])59%12[B]([Cl])01%13[B]([Cl])2345 |
|---|---|
| SI-enheter & STP används om ej annat angivits | |
Karboransyra, summaformel H(CHB11Cl11), ingår i en klass av supersyror[1] – betydelsefull inom den organiska kemin, bland annat vid utveckling av vitaminpreparat. Karboransyra fräter inte på glas och kan därför lagras i glaskärl, till skillnad från många andra supersyror, vilka några uppskattas vara minst en miljon gånger starkare än 100-procentigt ren svavelsyra i termer av deras Hammett-syrafunktionsvärden (H0 ≤–18) och har beräknade pKa-värden långt under –20, vilket fastställer dem som några av de starkaste kända Brønsted-syrorna.[2][3][4] Det bäst studerade exemplet är det högklorerade derivatet H(CHB)11 Cl11). Surheten av H(CHB11Cl11) visade sig vida överskrida triflinsyra, CF3SO3H, och bistriflimid, (CF3SO2)2NH, föreningar som tidigare betraktades som de starkaste isolerbara syrorna.
Deras höga surheter härrör från den omfattande delokaliseringen av deras konjugatbaser, karboanatanjoner (CXB11Y5Z6−), som vanligtvis stabiliseras ytterligare av elektronegativa grupper som Cl, F och CF3. På grund av bristen på oxiderande egenskaper och den exceptionellt låga nukleofilicieten och höga stabiliteten hos deras konjugatbaser, är de de enda supersyrorna som är kända för att protonera C60 fulleren utan att sönderdela den.[5][6] Dessutom bildar de stabila, isolerbara salter med protonerad bensen, C6H7+, moderföreningen till Wheland-intermediärerna som påträffas i elektrofila aromatiska substitutionsreaktioner.
Den fluorerade karboransyran, H(CHB11F11), är till och med starkare än klorerad karboransyra. Den kan protonera butan för att bilda tert-butylkatjon vid rumstemperatur och är den enda kända syran som protonerar koldioxid för att ge den överbryggade katjonen, [H(CO)2)2]+, vilket gör den möjligen till den starkaste kända syran. I synnerhet CO2 genomgår inte observerbar protonering när den behandlas med de blandade supersyrorna HF-SbF5 eller HSO3F-SbF5.[7][8][9]
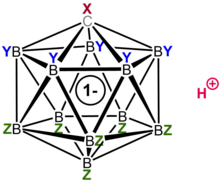
Som en klass utgör karboransyrorna den suraste gruppen av väldefinierade, isolerbara ämnen som är kända, mycket surare än tidigare kända enkomponents starka syror som triflinsyra eller perklorsyra. I vissa fall, som de nästan perhalogenerade derivaten som nämns ovan, konkurrerar deras surheter med (och överstiger möjligen) de hos de traditionella blandade Lewis-Brønsted-supersyrorna som magisk syra och fluoroantimonisk syra. (En direkt jämförelse har dock inte varit möjlig hittills, på grund av bristen på ett mått på surhet som är lämpligt för båda klasserna av syror. pKa-värden är dåligt definierade för de kemiskt komplexa blandade syrorna medan H0-värdena inte kan mätas för de mycket högsmältande karbonsyrorna).
Surhet

En Brønsted-Lowry-syras styrka motsvarar dess förmåga att frigöra en vätejon. Ett vanligt mått på syrastyrka för koncentrerade, supersura flytande medier är Hammetts surhetsfunktion, H0. Baserat på dess förmåga att kvantitativt protonera bensen, bedömdes den klorerade karboransyran H(CHB)11Cl11) konservativt ha ett H0-värde på eller under -18, vilket leder till det vanliga påståendet att karboransyror är minst en miljon gånger starkare än 100-procentig svavelsyra (H0 = -12).[11][12] Men eftersom H0-värdet mäter protoneringsförmågan hos ett flytande medium, utesluter den kristallina och högsmältande naturen hos dessa syror direkt mätning av denna parameter. När det gäller pKa, ett något annorlunda mått på surhet definierat som förmågan hos ett givet löst ämne att genomgå jonisering i ett lösningsmedel, beräknas karboransyrorna ha pKa-värden under -20, även utan elektronbortdragande substituenter på boratomerna (till exempel H(CHB11H11) uppskattas ha ett pKa på -24),[13] med den (ännu okänd 2023) helt fluorerade analogen H(CB)11F12) med ett beräknat pKa på -46.[4] Den kända syran H(CHB11F11) med en mindre fluor förväntas vara endast något svagare (pKa < -40).
I gasfasen har H(CHB11F11) en beräknad surhet på 216 kcal/mol, jämfört med en experimentellt bestämd surhet på 241 kcal/mol (i rimlig överensstämmelse med det beräknade värdet på 230 kcal/mol) för H(CHB)11Cl11). Däremot har HSbF6 (en förenklad modell för den protondonerande arten i fluorantimonsyra) en beräknad gasfassyrahalt på 255 kcal/mol, medan den tidigare experimentellt bestämda rekordhållaren var (C4F9SO2)2NH, en kongener av bistriflimid, vid 291 kcal /mol. Således är H(CHB11F11) sannolikt det suraste ämnet hittills som syntetiserats i bulk, vad gäller dess surhet i gasfas. Med tanke på sin unika reaktivitet är det också en stark utmanare för att vara det suraste ämnet i den kondenserade fasen (se ovan). Vissa ännu starkare sura derivat har förutspåtts, med surheter i gasfas < 200 kcal/mol.[14][15]
Karboransyror skiljer sig från klassiska supersyror genom att vara väldefinierade enkomponentsämnen. Däremot är klassiska supersyror ofta blandningar av en Brønsted-syra och Lewis-syra (till exempel HF/SbF5).[6] Trots att de är den starkaste syran beskrivs de borbaserade karboransyrorna som "snälla", som rent protonerar svagt basiska ämnen utan ytterligare bireaktioner.[16] Medan konventionella supersyror bryter ner fullerener på grund av deras starkt oxiderande Lewis-syrakomponent, har karboransyra förmågan att protonera fullerener vid rumstemperatur för att ge ett isolerbart salt.[17][6] Dessutom är anjonen som bildas som ett resultat av protonöverföring nästan helt inert. Det är denna egenskap som gör karboransyrorna till de enda substanserna som är jämförbara i surhet med de blandade supersyrorna som också kan lagras i en glasflaska, eftersom olika fluordonerande arter (som angriper glas) inte finns eller genereras.[18][17]
Användning
Det finns många föreslagna tillämpningar för de borbaserade karboransyrorna. Till exempel har de föreslagits som katalysatorer för kolvätekrackning och isomerisering av n-alkaner för att bilda grenade isoalkaner ("isooktan", till exempel). Karboransyror kan också användas som starka, selektiva Brønsted-syror för finkemisk syntes, där motanjonens låga nukleofiliciet kan vara fördelaktigt. I mekanistisk organisk kemi kan de användas i studiet av reaktiva katjoniska intermediärer.[19] I oorganisk syntes kan deras oöverträffade surhet möjliggöra isolering av exotiska arter som salter av protonerat xenon.[18][20][21]
Se även
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Carborane acid, 2 november 2023.
- ^ Note that the image the acidic proton is not the one bonded to the carborane but that it is the counterion not displayed.
- ^ Olah, G. A.; Prakash, G. K. S.; Sommer, J.; Molnar, A. (2009). Superacid Chemistry (2nd). Wiley. sid. 41. ISBN 978-0-471-59668-4
- ^ That is, were it liquid, the protonating ability of a neat sample of the carborane superacid, as measured by the activity of H+, would be a million times higher than that of 100% sulfuric acid.
- ^ [a b] Lipping, Lauri; Leito, Ivo; Koppel, Ivar; Krossing, Ingo; Himmel, Daniel; Koppel, Ilmar A. (2015-01-14). ”Superacidity of closo -Dodecaborate-Based Brønsted Acids: a DFT Study” (på engelska). The Journal of Physical Chemistry A 119 (4): sid. 735–743. doi:. PMID 25513897. Bibcode: 2015JPCA..119..735L.
- ^ Juhasz, M.; Hoffmann, S.; Stoyanov, E.; Kim, K.-C.; Reed, C. A. (2004). ”The Strongest Isolable Acid”. Angewandte Chemie International Edition 43 (40): sid. 5352–5355. doi:. PMID 15468064.
- ^ [a b c] Reed C. A. (2005). ”Carborane acids. "New 'strong yet gentle' Acids For Organic and Inorganic Chemistry”. Chemical Communications 2005 (13): sid. 1669–1677. doi:. PMID 15791295. http://www.escholarship.org/uc/item/90p8v05h.
- ^ Nava Matthew (2013). ”The Strongest Brønsted Acid: Protonation of Alkanes by H(CHB11F11) at Room Temperature”. Angewandte Chemie International Edition 53 (4): sid. 1131–1134. doi:. PMID 24339386.
- ^ Reed, Christoher A. (2013). ”Myths about the proton. The nature of H+ in condensed media”. Accounts of Chemical Research 46 (11): sid. 2567–75. doi:. PMID 23875729.
- ^ Cummings, Steven; Hratchian, Hrant P.; Reed, Christopher A. (2016-01-22). ”The Strongest Acid: Protonation of Carbon Dioxide” (på engelska). Angewandte Chemie International Edition 55 (4): sid. 1382–1386. doi:. ISSN 1521-3773. PMID 26663640. http://www.escholarship.org/uc/item/1gx5d8tf.
- ^ Stoyanov, Evgenii S.; Hoffmann, Stephan P.; Juhasz, Mark; Reed, Christopher A. (March 2006). ”The Structure of the Strongest Brønsted Acid: The Carborane Acid H(CHB11Cl11)” (på engelska). Journal of the American Chemical Society 128 (10): sid. 3160–3161. doi:. ISSN 0002-7863. PMID 16522093. https://escholarship.org/uc/item/46n3p50s.
- ^ Reed, C. A. (October 2011). ”The Strongest Acid”. Chem. New Zealand 75: sid. 174–179. doi:.
- ^ Olah, G. A.; Prakash, G. K. S.; Sommer, J.; Molnar, A. (2009). Superacid Chemistry (2nd ed.). Wiley. p. 41. ISBN 978-0-471-59668-4.
- ^ The pKa values are calculated for 1,2-dichloroethane as the solvent, with the pKa of picric acid 'anchored' to 0 for convenience. Since the aqueous pKa of picric acid is 0.4, these calculated values give a crude estimate of the pKa of carboranes in water.
- ^ Meyer, Matthew M.; Wang, Xue-Bin; Reed, Christopher A.; Wang, Lai-Sheng; Kass, Steven R. (2009-12-23). ”Investigating the weak to evaluate the strong: an experimental determination of the electron binding energy of carborane anions and the gas phase acidity of carborane acids”. Journal of the American Chemical Society 131 (50): sid. 18050–18051. doi:. ISSN 1520-5126. PMID 19950932. http://www.escholarship.org/uc/item/5qv4v9pn.
- ^ Lipping, Lauri; Leito, Ivo; Koppel, Ivar; Koppel, Ilmar A. (2009-11-19). ”Gas-Phase Brønsted Superacidity of Some Derivatives of Monocarba-closo-Borates: a Computational Study”. The Journal of Physical Chemistry A 113 (46): sid. 12972–12978. doi:. ISSN 1089-5639. PMID 19807147. Bibcode: 2009JPCA..11312972L.
- ^ Reed, Christopher A. (October 2011). ”The Strongest Acid”. Chemistry in New Zealand 75 (4): sid. 174–179. https://reedgrouplab.ucr.edu/publications/NZIC-published.pdf. Läst 13 februari 2015.
- ^ [a b] Juhasz M.; Hoffmann S.; Stoyanov E.; Kim K.-C.; Reed C. A. (2004). ”The Strongest Isolable Acid”. Angewandte Chemie International Edition 43 (40): sid. 5352–5355. doi:. PMID 15468064.
- ^ [a b] Hopkin, M. (2004, November 1). World's strongest acid created. Hämtad 3 mars 2015, from http://www.nature.com/news/2004/041115/full/news041115-5.html
- ^ Lovekin Kris. "Strong, Yet Gentle, Acid Uncovered". University of California, Riverside. (November, 2004). Accessed February 13, 2015.
- ^ Sato, Kentaro. ”The World's Strongest Acid”. The Museum of Organic Chemistry: The Art and Story of Molecular World. http://www.org-chem.org/yuuki/acid/acid_en.html. Arkiverad 9 mars 2019 hämtat från the Wayback Machine.
- ^ Stiles, D. (September 1, 2007). ”Column: Bench monkey”. Column: Bench monkey. http://www.rsc.org/chemistryworld/Issues/2007/September/ColumnBenchMonkey.asp.
Externa länkar
Media som används på denna webbplats
Författare/Upphovsman: Alsosaid1987, Licens: CC BY-SA 4.0
generic carborane acid
Författare/Upphovsman: Alsosaid1987, Licens: CC BY-SA 4.0
structural formula of the chlorinated carborane acid


