Kaliumsulfid
| Kaliumsulfid | |
 | |
| Systematiskt namn | Kaliumsulfid |
|---|---|
| Övriga namn | Dikaliumsulfid Dikaliummonosulfid Kaliummonosulfid |
| Kemisk formel | K2S |
| Molmassa | 110,262 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 1312-73-8 |
| Egenskaper | |
| Densitet | 1,8 g/cm³ |
| Löslighet (vatten) | omvandlas till KSH och KOH |
| Smältpunkt | 840 °C |
| Kokpunkt | (söderdelas) |
| Faror | |
| NFPA 704 | |
| SI-enheter & STP används om ej annat angivits | |
Kaliumsulfid är en kemisk förening med formeln K2S. Denna färglösa solid påträffas sällan då ämnet raskt reagerar med vatten; en reaktion som ger kaliumvätesulfid (KSH) och kaliumhydroxid (KOH).
Struktur
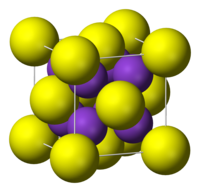
Kaliumsulfid antar antifluoritstruktur, vilket betyder att de små K+-jonerna upptar de tetrahedrala (F-) platserna i fluorit, och de större S2--jonerna upptar de åttakoordinerade Ca2+-platserna. Litiumsulfid (Li2S), natriumsulfid (Na2S) och rubidiumsulfid (Rb2S) kristalliserar sig på samma sätt.
Tillverkning och reaktioner
K2S uppstår från reaktionen av kalium och svavel. I laboratoriet utförs denna syntes vanligtvis genom att kombinera en lösning av kalium i vattenfri ammoniak med rent svavel.
Detta salt innehåller den starkt basiska anjonen S2−, som fullständigt hydrolyseras i vatten enligt följande reaktionsformel:
- K2S + H2O → KOH + KSH
Denna reaktion är dock inkonsekvent eftersom blandningen av SH− och OH− beter sig som en källa till S2−. Andra alkalimetallsulfider beter sig på samma sätt.
Användningsområden
Kaliumsulfider bildas när krut förbränns och är viktiga intermediat i många pyrotekniska effekter, såsom senko hanabi och vissa glitterprodukter.
Se även
Källor
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Potassium sulfide, 26 februari 2010.
Media som används på denna webbplats
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.


