Indol
| Indol | |
  | |
| Systematiskt namn | 2,3-Bensopyrrol |
|---|---|
| Övriga namn | Ketol |
| Kemisk formel | C8H6NH |
| Molmassa | 117,15 g/mol |
| Utseende | Färglösa kristaller |
| CAS-nummer | 120-72-9 |
| SMILES | C1(NC=C2)=C2C=CC=C1 |
| Egenskaper | |
| Densitet | 1,22 g/cm³ |
| Löslighet (vatten) | 3,56 g/l (25 °C) |
| Smältpunkt | 52 – 54 °C |
| Kokpunkt | 253 – 254 °C |
| Faror | |
| Huvudfara | |
| SI-enheter & STP används om ej annat angivits | |
Indol eller 2,3-bensopyrrol är en aromatisk, heterocyklisk och organisk förening med en 6-kols bensenring sammankopplad med en 5-kols pyrrolring innehållande en kväveatom.
Namnet
Indol har sitt namn efter färgämnet indigo. Den tyske kemisten Adolf von Baeyer fann detta ämne 1866, när han sökte en grundstruktur, enklast möjliga ämne att utgå ifrån, för syntetisk framställning av Indigo, och gav det namnet "Indol", i analogi med det tyska namnet "Benzol" för bensen, det enklaste aromatiska kolvätet.[1][2]
Egenskaper
Till skillnad från många andra aminer är indol inte basisk. Pyrrolringen är starkt nukleofil och 1013 gånger mer reaktiv än bensenringen.
Förekomst
Indol är en metabolit av aminosyran tryptofan och förekommer i avföring som till stor del får sin säregna lukt av indol och merkaptaner. Den förekommer också i stenkolstjära.
Framställning
Indol utvinns huvudsakligen genom destillation av stenkolstjära, men det finns flera sätt att framställa indol på syntetisk väg.
Fischer-syntes
Den äldsta och mest tillförlitliga metoderna kallas Fischer-syntes efter den tyske kemisten Hermann Emil Fischer. Fenylhydrazin (C6H5N2H3) och acetaldehyd (CH3CHO) reagerar med varandra med en syra som katalysator.
Leimgruber-Batcho-syntes
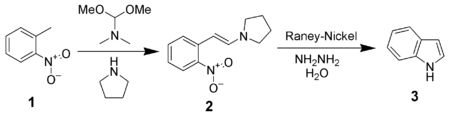
En modernare metod kallas Leimgruber-Batcho-syntes. Den bygger på en tvåstegsprocess där 2-nitrotoluen (C6H4(CH3)NO2) får reagera med en acetal och pyrrolidin (C4H9N) för att bilda motsvarande enamin.
I andra steget reduceras enaminen med raneynickel som katalysator till indol.
Användning
Indol används som syntetisk jasmin-doft i parfym. Substituerade indoler används ofta i läkemedel.
Se även
Referenser
- ^ Alex Nickon, Ernest F. Silversmith. Organic Chemistry: The Name Game: Modern Coined Terms and Their Origins Pergamon Press, 1987. Läst 15 februari 2019.
- ^ Carsten Reinhardt, Anthony S. Travis. Heinrich Caro and the Creation of Modern Chemical Industry Springer Science & Business Media, 2000, s. 188. Läst 15 februari 2019.
Media som används på denna webbplats
Chemical diagram showing a generic Fischer indole synthesis reaction