Glykosyltransferas
Glykosyltransferaser är en grupp enzymer (EC 2.4) som svarar för biosyntesen av disackarider, oligosackarider och polysackarider. De katalyserar överföringen av sackariddelar från ett aktiverat nukleotidsocker (även känt som "glykosyldonatorn") till en nukleofil glykosylacceptormolekyl, vars nukleofil kan vara syre-, kol-, kväve- eller svavelbaserad.[1]
Resultatet av glykosylöverföring kan vara en kolhydrat, glykosid, oligosackarid eller en polysackarid. Vissa glykosyltransferaser katalyserar överföring till oorganiskt fosfat eller vatten. Glykosylöverföring kan också ske till proteinrester, vanligtvis till tyrosin, serin eller treonin för att ge syrelänkade glykoproteiner, eller till asparagin för att ge kvävelänkade glykoproteiner. Mannosylgrupper kan överföras till tryptofan för att generera C-mannosyltryptofan, vilket är relativt rikligt i eukaryoter. Transferaser kan också använda lipider som acceptor, bilda glykolipider och till och med använda lipidbundna sockerfosfatgivare, såsom dolicholfosfater i eukaryot organism eller undekaprenylfosfat i bakterier.
Glykosyltransferaser som använder sockernukleotiddonatorer är Leloir-enzymer, namngivna efter Luis F. Leloir, forskaren som upptäckte den första sockernukleotiden och som fick Nobelpriset i kemi 1970 för sitt arbete med kolhydratmetabolism. Glykosyltransferaser som använder icke-nukleotiddonatorer såsom dolichol eller polyprenolpyrofosfat är icke-Leloir-glykosyltransferaser.
Däggdjur använder endast 9 sockernukleotidgivare för glykosyltransferaser:[2] UDP-glukos, UDP-galaktos, UDP-GlcNAc, UDP-GalNAc, UDP-xylos, UDP-glukuronsyra, BNP-mannos, BNP-fukos och CMP-sialinsyra. Fosfat(erna) av dessa givarmolekyler samordnas vanligtvis av tvåvärda katjoner såsom mangan, men metalloberoende enzymer existerar.
Många glykosyltransferaser är enkelpasstransmembranproteiner, och de är vanligtvis förankrade i membran i Golgiapparater.[3]
Mekanism
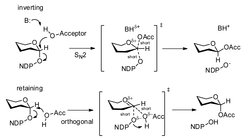
Glykosyltransferaser kan separeras i "behållande" eller "inverterande" enzymer beroende på om stereokemin hos givarens anomera bindning behålls (α→α) eller inverteras (α→β) under överföringen. Inverteringsmekanismen är enkel och kräver en enda nukleofil attack från den accepterande atomen för att invertera stereokemi.
Kvarhållningsmekanismen har varit en fråga under debatt, men det finns starka bevis mot en dubbelförskjutningsmekanism (vilket skulle orsaka två inversioner om det anomera kolet för en nettoretention av stereokemi) eller en dissociativ mekanism (en utbredd variant av vilken var känd som SNi). En "ortogonal associativ" mekanism har föreslagits som, i likhet med de inverterande enzymerna, endast kräver en enda nukleofil attack från en acceptor från en icke-linjär vinkel (som observerats i många kristallstrukturer) för att uppnå anomerretention.[4]
Reaktionens reversibilitet
Den senaste upptäckten av reversibiliteten hos många reaktioner som katalyseras av inverterande glykosyltransferaser fungerade som ett paradigmskifte inom området och väcker frågor om beteckningen av sockernukleotider som "aktiverade" givare.[5][6][7][8][9]
Klassificering av sekvens
Sekvensbaserade klassificeringsmetoder har visat sig vara ett kraftfullt sätt att generera hypoteser för proteinfunktion baserat på sekvensanpassning till relaterade proteiner. Den kolhydrataktiva enzymdatabasen presenterar en sekvensbaserad klassificering av glykosyltransferaser i över 90 familjer.[10] Samma tredimensionella veck förväntas inträffa inom var och en av familjerna.[11]
Struktur
I motsats till mångfalden av 3D-strukturer som observerats för glykosidhydrolaser har glykosyltransferas ett mycket mindre spektrum av strukturer.[12][13] Enligt databasen för strukturell klassificering av proteiner har endast tre olika veck observerats för glykosyltransferaser.[14] Mycket nyligen identifierades ett nytt glykosyltransferasveck för glykosyltransferaserna som är involverade i biosyntesen av NAG-NAM-polymerens ryggrad av peptidoglykan.[15]
Hämmare
Många hämmare av glykosyltransferaser är kända. Några av dessa är naturliga produkter, som moenomycin, en hämmare av peptidoglykanglykosyltransferaser, nikkomycinerna, hämmare av kitinsyntas och echinocandinerna, hämmare av svamp β-1,3-glukansyntaser. Vissa glykosyltransferashämmare är användbara som läkemedel eller antibiotika. Moenomycin används i djurfoder som tillväxtförstärkare. Caspofungin har utvecklats från echinocandiner och används som ett svampdödande medel. Etambutol är en hämmare av mykobakteriella arabinotransferaser och används för behandling av tuberkulos. Lufenuron är en hämmare av insektskitinsynteser och används för att bekämpa loppor hos djur. Imidazoliumbaserade syntetiska hämmare av glykosyltransferaser har utformats för användning som antimikrobiella och antiseptiska medel.[16]
Användning
Glykosyltransferaser har använts i stor utsträckning i både den riktade syntesen av specifika glykokonjugat såväl som syntesen av differentiellt glykosylerade bibliotek av läkemedel, biologiska sonder eller naturliga produkter i samband med läkemedelsupptäckt och läkemedelsutveckling (en process som kallas glykorandomisering).[17] Lämpliga enzymer kan isoleras från naturliga källor eller produceras rekombinant. Som ett alternativ har helcellsbaserade system som använder antingen endogena glykosyldonatorer eller cellbaserade system som innehåller klonade och uttryckta system för syntes av glykosyldonatorer utvecklats. I cellfria tillvägagångssätt har storskalig applicering av glykosyltransferaser för glykokonjugatsyntes krävt tillgång till stora mängder glykosyldonatorer. Å andra sidan har nukleotidåtervinningssystem som möjliggör resyntes av glykosyldonatorer från den frigjorda nukleotiden utvecklats. Nukleotidåtervinningsmetoden har ytterligare en fördel när det gäller att minska mängden nukleotid som bildas som en biprodukt och därigenom minska mängden hämning som orsakas av glykosyltransferaset av intresse - en vanligt observerad egenskap hos nukleotidbiprodukten.
Se även
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Glycosyltransferase, 28 november 2021.
Noter
- ^ Williams, GJ; Thorson, JS (2009). Natural product glycosyltransferases: properties and applications.. Advances in Enzymology - and Related Areas of Molecular Biology. "76". Sid. 55–119. doi:. ISBN 9780470392881.
- ^ Essentials of Glycobiology (2nd). Plainview, N.Y: Cold Spring Harbor Laboratory Press. 2008. ISBN 978-0-87969-770-9.
- ^ Transferases in Membranome database.
- ^ ”Geometric Attributes of Retaining Glycosyltransferase Enzymes Favor an Orthogonal Mechanism”. PLOS ONE 8 (8): sid. e71077. August 2013. doi:. PMID 23936487. Bibcode: 2013PLoSO...871077S.
- ^ Zhang, C; Griffith, BR; Fu, Q; Albermann, C; Fu, X; Lee, IK; Li, L; Thorson, JS (1 September 2006). ”Exploiting the reversibility of natural product glycosyltransferase-catalyzed reactions.”. Science 313 (5791): sid. 1291–4. doi:. PMID 16946071. Bibcode: 2006Sci...313.1291Z.
- ^ Zhang, C; Albermann, C; Fu, X; Thorson, JS (27 December 2006). ”The in vitro characterization of the iterative avermectin glycosyltransferase AveBI reveals reaction reversibility and sugar nucleotide flexibility.”. Journal of the American Chemical Society 128 (51): sid. 16420–1. doi:. PMID 17177349.
- ^ Zhang, C; Fu, Q; Albermann, C; Li, L; Thorson, JS (5 March 2007). ”The in vitro characterization of the erythronolide mycarosyltransferase EryBV and its utility in macrolide diversification.”. ChemBioChem 8 (4): sid. 385–90. doi:. PMID 17262863.
- ^ Zhang, C; Moretti, R; Jiang, J; Thorson, JS (13 October 2008). ”The in vitro characterization of polyene glycosyltransferases AmphDI and NysDI.”. ChemBioChem 9 (15): sid. 2506–14. doi:. PMID 18798210.
- ^ Gantt, RW; Peltier-Pain, P; Cournoyer, WJ; Thorson, JS (21 August 2011). ”Using simple donors to drive the equilibria of glycosyltransferase-catalyzed reactions.”. Nature Chemical Biology 7 (10): sid. 685–91. doi:. PMID 21857660.
- ^ CAZypedia Glycosyltransferases
- ^ ”CAZy Glycosyl Transferase”. Arkiverad från originalet den 23 mars 2009. https://web.archive.org/web/20090323075312/http://www.cazy.org/fam/acc_GT.html. Läst 7 december 2022.
- ^ Singh, S; Phillips GN, Jr; Thorson, JS (October 2012). ”The structural biology of enzymes involved in natural product glycosylation”. Natural Product Reports 29 (10): sid. 1201–37. doi:. PMID 22688446.
- ^ Chang, A; Singh, S; Phillips GN, Jr; Thorson, JS (December 2011). ”Glycosyltransferase structural biology and its role in the design of catalysts for glycosylation”. Current Opinion in Biotechnology 22 (6): sid. 800–8. doi:. PMID 21592771.
- ^ SCOP: Structural Classification of Proteins
- ^ ”Structural insight into the transglycosylation step of bacterial cell-wall biosynthesis”. Science 315 (5817): sid. 1402–5. March 2007. doi:. PMID 17347437. Bibcode: 2007Sci...315.1402L.
- ^ Kocev, A; Melamed, J; Wang, S; Kong, X; Vlahakis, JZ; Xu, Y; Szarek, WA; Brockhausen, I (June 2020). "Inhibition of bacterial growth and galactosyltransferase activity of WbwC by α, ω-bis(3-alkyl-1H-imidazolium)alkane salts: Effect of varying carbon content". Bioorganic and Medicinal Chemistry. 28 (11): 115494. doi:10.1016/j.bmc.2020.115494. PMID 32312486.
- ^ Gantt, RW; Peltier-Pain, P; Thorson, JS (October 2011). ”Enzymatic methods for glyco(diversification/randomization) of drugs and small molecules.”. Natural Product Reports 28 (11): sid. 1811–53. doi:. PMID 21901218.
Externa länkar
 Wikimedia Commons har media som rör Glykosyltransferas.
Wikimedia Commons har media som rör Glykosyltransferas.
Media som används på denna webbplats
(c) Dr.Brock.Schuman på engelska Wikipedia, CC BY-SA 3.0
Displays the associative chemical mechanisms utilized by retaining and inverting glycosyltransferases