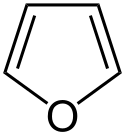
Furan
- För andra betydelser, se Furan (olika betydelser).
| Furan | |
  | |
| Systematiskt namn | Oxacyclopentadien |
|---|---|
| Övriga namn | Oxol |
| Kemisk formel | C4H4O |
| Molmassa | 68,074 g/mol |
| Utseende | Färglös, flyktig vätska |
| CAS-nummer | 110-00-9 |
| SMILES | C1=CC=CO1 |
| Egenskaper | |
| Densitet | 0,94 g/cm³ |
| Löslighet (vatten) | 10 g/l (20 °C) |
| Smältpunkt | -85,6 °C |
| Kokpunkt | 31,4 °C |
| Faror | |
| Huvudfara | |
| NFPA 704 | |
| LD50 | 300 mg/kg (oralt) 7 mg/kg (intravenöst) |
| SI-enheter & STP används om ej annat angivits | |
Furan är en heterocyklisk organisk förening med den kemiska formeln C4H4O. Den består av en femledad ring med fyra kolatomer och en syreatom. Furan är en färglös, flyktig vätska med en kokpunkt på 31.3 °C. Den är lättantändlig och har en karakteristisk lukt.
Historik
Furan upptäcktes för första gången av den tyske kemisten Heinrich Limpricht år 1870. Han isolerade ämnet från furfural, en annan heterocyklisk förening. Limpricht beskrev dess egenskaper och struktur i en artikel publicerad i Journal für Praktische Chemie.[1]
Egenskaper
Furan är en aromatisk förening, vilket innebär att den har en stabil ringstruktur med delokaliserade elektroner. Denna egenskap gör att furan är mindre reaktiv än många andra heterocykliska föreningar. Furan är löslig i de flesta organiska lösningsmedel och är också löslig i vatten i viss utsträckning.[2]
Framställning
Furan framställs industriellt genom dekarboxylering av furfural. Processen innebär upphettning av furfural i närvaro av en katalysator, vilket leder till bildning av furan och koldioxid. Andra metoder för framställning av furan inkluderar dehydrering av pentoser, som är en typ av socker.[3]
Användning
Furan används huvudsakligen som en byggsten i syntesen av andra kemikalier. Det är en viktig råvara i tillverkningen av farmaceutiska produkter, färgämnen och polymerer. Furan används också som lösningsmedel i vissa industriella processer.[2]
Säkerhet
Furan är en giftig förening och kan orsaka skador på levern och njurarna vid exponering. Den är också klassificerad som en möjlig cancerframkallande förening av Internationella Cancerforskningsagenturen (IARC). Personer som hanterar furan bör använda skyddsutrustning och arbeta i välventilerade områden.[4]
Referenser
- ^ Limpricht, H. (1870). "Ueber das Furan". Journal für Praktische Chemie. 1(1): 123-128.
- ^ [a b] Smith, J. G. (1963). "The Chemistry of Heterocyclic Compounds: Furans". Interscience Publishers.
- ^ Dean, F. M. (1982). "Advances in Heterocyclic Chemistry: Furans". Academic Press.
- ^ International Agency for Research on Cancer (IARC). "Furan". IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Volume 101F.
Litteratur
- Limpricht, H. (1870). "Ueber das Furan". Journal für Praktische Chemie. 1(1): 123-128.
- Smith, J. G. (1963). "The Chemistry of Heterocyclic Compounds: Furans". Interscience Publishers.
- Dean, F. M. (1982). "Advances in Heterocyclic Chemistry: Furans". Academic Press.
- International Agency for Research on Cancer (IARC). "Furan". IARC Monographs on the Evaluation of Carcinogenic Risks to Humans. Volume 101F.
Externa länkar
Media som används på denna webbplats
The "fire diamond" as defined by NFPA 704. It is a blank template, so as to facilitate populating it using CSS.
Structure of furan
Ball-and-stick model of the furan molecule, C4H4O.
Structural information (determined by microwave spectroscopy) from CRC Handbook, 88th edition.
Image generated in Accelrys DS Visualizer.