Fotokemi
Fotokemi, ett fält inom kemi, är studiet av interaktioner mellan atomer, små molekyler och elektromagnetisk strålning (framförallt synligt ljus samt infraröd och ultraviolett strålning). Fotokemi kan betraktas som en del av den fysikaliska kemin.
Fotokemins grundprinciper
Fotokemins första lag, Grotthuss-Drapers lag (efter kemisterna Theodor Grotthuss och John W. Draper), slår fast att ljus måste absorberas av ett kemiskt ämne för att en fotokemisk reaktion ska ske. Detta skiljer fotokemiska reaktioner från andra kemiska reaktioner, som oftast får den aktiveringsenergi som krävs för att reaktionen ska ske från värme.
Fotokemins andra lag, Stark-Einsteins lag, säger att för varje foton som absorberas av ett kemiskt system så kommer endast en molekyl att aktiveras för att delta i en fotokemisk reaktion. Lagen kallas även fotoekvivalenslagen och härleddes av Albert Einstein när kvantmekanikens beskrivning av ljus som fotoner utvecklades.
Fotoner ger inte bara molekyler tillräckligt med energi för att reagera. De kan också ändra symmetrin hos molekylens elektronkonfiguration, så att en annars omöjlig reaktionsväg kan följas. Hur symmetriändringarna sker beskrivs av Woodward-Hoffmanns regler. En 2+2-cykloadditionsreaktion är ett exempel på en pericyklisk reaktion som kan analyseras med dessa regler eller med den liknande frontorbitalteorin. En annan fotokemisk reaktion är isomeriseringen av retinal i ögat, som är den kemiska reaktion som gör att ögat kan reagera på ljus. Fotosyntes inleds också med en fotokemisk reaktion.
Energinivåer
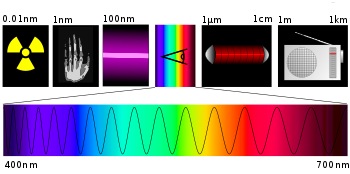
I kvantmekanikens beskrivning av atomer och molekyler kan de inte ha vilka energinivåer som helst; energinivåerna är åtskilda (kvantiserade). De olika energinivåerna kan vara olika elektronenerginivåer, men också rotations-, vibrations- och translationsenergi. De olika energinivåerna studeras med spektroskopi, som utnyttjar att ljus med en bestämd våglängd också har en bestämd energi. Om det inkommande ljuset har samma energi som skillnaden mellan en lägre och en högre energinivå kan atomen eller molekylen absorbera ljuset och övergå till den högre energinivån. På samma sätt kan en atom eller molekyl gå från en högre energinivå till en lägre genom att sända ut ljus med lämplig våglängd. Detta kallas spontan emission. Fenomenen fluorescens och fosforescens bygger på denna princip. En lite mer komplicerad variant (stimulerad emission) ger upphov till laserljus.
Ett viktigt begrepp inom fotokemi är kvantutbyte, som är den andel infallande ljus på ett ämne som ger upphov till en reaktion. Om atomen eller molekylen emitterar ljuset igen utan att reagera bidrar det till att utbytet inte blir 100 %.
Se även
Källor
- Atkins, P och de Paula, J. Atkins' Physical Chemistry. Oxford, Storbritannien: Oxford University Press, 2002. ISBN 0-19-879285-9
- Bruice, PY. Organic Chemistry. Upper Saddle River, New Jersey, USA: Pearson Education, 2004. ISBN 0-13-121730-5
|
Media som används på denna webbplats
Författare/Upphovsman: Tatoute and Phrood~commonswiki, Licens: CC BY-SA 3.0
Indelning av det elektromagnetiska spektrumet.