Eclipsed
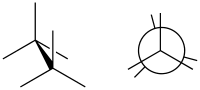
(till höger i Newmanprojektion)

Eclipsed ("förmörkad") kallas den konformation där två substituenter X och Y på intilliggande atomer A, B är närmast varandra, vilket antyder att torsionsvinkeln X–A–B–Y är 0°.[1] En sådan konformation kan existera i vilken öppen kedja som helst, enkel kemisk bindning som förbinder två sp3-hybridiserade atomer, och det är normalt ett konformationellt energimaximum. Detta maximum förklaras ofta av steriskt hinder, men dess ursprung ligger ibland faktiskt i hyperkonjugering (som när den "förmörkande" interaktionen är av två väteatomer).
En molekyl som befinner sig i en eclipsed konformation besitter ofta en högre energi än motsvarande staggered konformation. Detta beror på steriska interaktioner mellan substituenterna, som hamnar nära varandra.
För att få en djupare förståelse av ”förmörkade” konformationer i organisk kemi är det först viktigt att förstå hur organiska molekyler är ordnade runt bindningar, samt hur de rör sig och roterar.
I exemplet etan är två metylgrupper förbundna med en kol-kol sigmabindning, precis som man kan koppla ihop två legobitar genom en enda "stift" och "rör". Med denna bild i åtanke, om metylgrupperna roteras runt bindningen, kommer de att förbli sammankopplade, men formen kommer att ändras. Detta leder till flera möjliga tredimensionella arrangemang, kända som konformationer, konformationsisomerer (konformerer), eller ibland rotationsisomerer (rotamerer).[2]
Organisk kemi
Konformationer kan beskrivas med dihedriska vinklar, som används för att bestämma placeringen av atomer och deras avstånd från varandra och kan visualiseras med Newman-projektioner. En dihedrisk vinkel kan ange förskjuten och ”förmörkad” orientering, men används specifikt för att bestämma vinkeln mellan två specifika atomer på motsatta kol. Olika konformationer har ojämlika energier, vilket skapar en energibarriär för bindningsrotation som är känd som vridningstöjning. I synnerhet tenderar ”förmörkade” konformationer att ha höjda energier på grund av avstötningen av elektronmolnen hos de ”förmörkade” substituenterna.

De relativa energierna för olika konformationer kan visualiseras med hjälp av grafer. I exemplet etan visar en sådan graf att rotation runt kol-kolbindningen inte är helt fri utan att det finns en energibarriär. Etanmolekylen i den ”förmörkade” konformationen sägs lida av vridningstöjning, och genom en rotation runt kolbindningen till den förskjutna konformationen frigörs cirka 12,5 kJ/mol vridenergi.
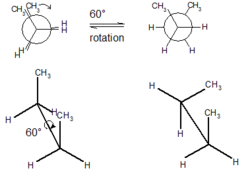
När det gäller butan och dess fyrkolskedja finns tre kol-kolbindningar tillgängliga att rotera. Exemplet nedan ser ner på C2- och C3-bindningen. Nedan är sågbocken och Newman-representationen av butan i en ”förmörkad” konformation med de två CH3-grupperna (C1 och C4) i en 0 graders vinkel från varandra (vänster).
Om fronten roteras 60° medurs, är butanmolekylen nu i en förskjuten konformation (höger). Denna konformation hänvisas mer specifikt till som gauche-konformationen av butan. Detta beror på att metylgrupperna är förskjutna, men endast 60° från varandra. Denna konformation är mer energiskt gynnad än den ”förmörkade” konformationen, men det är inte den mest energimässigt gynnsamma konformationen. En annan 60° rotation ger oss en andra ”förmörkad” konformation där båda metylgrupperna är i linje med väteatomer. En till 60° rotation ger en annan förskjuten konformation som kallas antikonformationen. Detta inträffar när metylgrupperna är placerade mitt emot (180°) varandra. Detta är den mest energimässigt gynnsamma konformationen.[3]
Minima kan ses på grafen vid 60, 180 och 300 grader medan maxima kan ses vid 0, 120, 240 och 360 grader. Maxima representerar de ”förmörkade” konformationerna på grund av den dihedrala vinkeln på noll grader.[4]
Strukturella tillämpningar
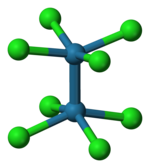
Som fastställts av röntgenkristallografi har oktaklordimolybdat(II)-anjon ([Mo2Cl8]4-) en ”förmörkad” konformation. Denna steriskt ogynnsamma geometri ges som bevis för en fyrdubbel bindning mellan Mo-centra.[5]
Experiment som röntgen- och elektrondiffraktionsanalyser, kärnmagnetisk resonans, mikrovågsspektroskopier med mera har gjort det möjligt för forskare att avgöra vilka cykloalkanstrukturer som är mest stabila baserat på de olika möjliga konformationerna. En annan metod som visade sig vara framgångsrik är molekylär mekanik, en beräkningsmetod som gör att de totala töjningsenergierna för olika konformationer kan hittas och analyseras. Det visade sig att de mest stabila konformationerna hade lägre energier baserat på energivärden grundade på bindningsavstånd och bindningsvinklar.[6]
I många fall har isomerer av alkaner med grenade kedjor lägre kokpunkter än de som är ogrenade, vilket har visats genom experiment med isomerer av C8H18. Detta beror på en kombination av intermolekylära krafter och storlek som resulterar från de grenade kedjorna. Ju fler grenar en alkan har, desto mer utsträckt är dess form. Samtidigt kommer den, om den är mindre grenad, att ha fler intermolekylära attraktionskrafter som måste brytas, vilket är orsaken till den ökade kokpunkten för ogrenade alkaner. I ett annat fall är 2,2,3,3-tetrametylbutan mer formad som en ellipsoid vilket gör att den kan bilda ett kristallgitter som höjer molekylens smältpunkt eftersom det går åt mer energi att övergå från ett fast ämne till ett flytande tillstånd.[6]
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Eclipsed conformation, 25 januari 2023.
Noter
- ^ Eliel, Ernest L.; Wilen, Samuel H. (1994). Stereochemistry of Organic Compounds. Wiley. sid. 1197. ISBN 978-0-471-01670-0
- ^ Ashenhurst, James (28 februari 2020). ”Staggered vs Eclipsed Conformations of Ethane”. Mastering Organic Chemistry. https://www.masterorganicchemistry.com/2020/02/28/staggered-vs-eclipsed-conformations-of-ethane/. Läst 15 november 2022.
- ^ ”hydrocarbon – Three-dimensional structures | Britannica” (på engelska). www.britannica.com. https://www.britannica.com/science/hydrocarbon/Three-dimensional-structures. Läst 15 november 2022.
- ^ ”3.4.1. Newman Projections” (på engelska). Chemistry LibreTexts. 16 juni 2015. https://chem.libretexts.org/Courses/Purdue/Purdue_Chem_26100%3A_Organic_Chemistry_I_(Wenthold)/Chapter_03%3A_Structure_of_Alkanes/3.4.%09Structure_and_Conformations_of_Alkanes/3.4.1._Newman_Projections. Läst 15 november 2022.
- ^ Brignole, A. B.; Cotton, F. A.; Dori, Z. (1972). ”Rhenium and Molybdenum Compounds Containing Quadruple Bonds”. Inorg. Synth. 13: sid. 81–89. doi:.
- ^ [a b] ”hydrocarbon – Three-Dimensional Structures”. Britannica. https://www.britannica.com/science/hydrocarbon/Three-dimensional-structures. Läst 15 november 2022.
Externa länkar
Media som används på denna webbplats
Författare/Upphovsman: Mr.Holmium, Licens: CC BY-SA 3.0
60 degrees rotation about single bond of butane to interconvert one conformer to another. Above: Newman projection; below: depiction of spatial orientation.
Eclipsed conformation (image right in Newman projection)
Staggered conformation image, right in Newman projection
Författare/Upphovsman: Keministi, Licens: CC0
Newman projections of ethane conformations & their relative energy differences (not total energies). Conformations form when ethane rotates about one of its single covalent bond. Torsional/dihedral angle is shown on x-axis.
Conformations (according to IUPAC):
A: staggered
B: eclipsed
Valleys of the pink graph are conformations lowest in energy (shown as A). Peaks are conformations highest in energy (shown as B). B is highest & A lowest in energy. A is thus the most stable conformation.
Valleys are local energy minima. A can thus be classified as a rotamer (a class of conformers). Peaks are not rotamers, & are caused by repulsive forces of the hydrogens.
Source for conformation names & rotamer classification:
- Pure & Appl. Chem., Vol. 68, No. 12, pp. 2193-2222, 1996.
Source for the relative energy differences & other info in this description:
- McMurry JE (2003). Organic Chemistry. (8 ed.). Brooks Cole. p. 95. ISBN 9780840054449.




