Atomkärna

Atomkärnan är en samling av neutroner och protoner som sitter ihop. Atomkärnor bildar tillsammans med elektroner en atom. Antalet protoner i kärnan bestämmer vilket grundämne och antalet neutroner vilken isotop som atomen utgör. Väteatomkärnan är den enklaste, bestående av endast en proton.
I atomkärnan är det huvudsakligen två krafter som spelar roll - den elektromagnetiska kraften och den starka kärnkraften. Den elektromagnetiska kraften verkar repellerande då atomkärnans elektriska laddning är positiv. Den starka kärnkraften, som verkar mellan kärnpartiklar, är den attraherande kraften.
Historia
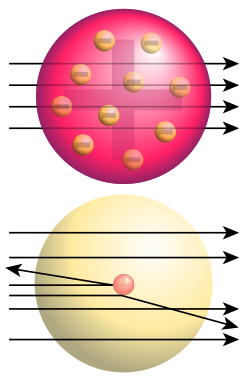
Upptäckten av atomkärnan tillskrivs Ernest Rutherford år 1909 när han lät beskjuta en tunn guldfolie med alfapartiklar. Detta experiment gjorde han tillsammans med Hans Geiger och Ernest Marsden vid universitetet i Manchester. Alla utom få partiklar gick rakt igenom folien, medan de få som inte gjorde så böjde av kraftigt. På detta sätt kunde han visa att atomens massa var samlad till en mycket liten volym i atomen. Denna avböjning går under namnet Rutherford-spridning.
Detta experiment har kommit att få flera namn; Geiger–Marsden-experimentet, Guldfolieexperimentet och Rutherford-experimentet (eng. The Geiger–Marsden experiment, the Gold foil experiment resp. the Rutherford experiment).
I detta experiment motbevisades Thomsons atommodell atommodell från 1904 och ledde till Bohrs atommodell 1913.
Se även
Externa länkar
 Wikimedia Commons har media som rör Atomkärna.
Wikimedia Commons har media som rör Atomkärna.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Media som används på denna webbplats
Författare/Upphovsman: User:Yzmo, Licens: CC BY-SA 3.0
A depiction of the atomic structure of the helium atom. The darkness of the electron cloud corresponds to the line-of-sight integral over the probability function of the 1s atomic orbital of the electron. The magnified nucleus is schematic, showing protons in red and neutrons in purple. In reality, the nucleus (and the wavefunction of each of the nucleons) is also spherically symmetric and 1s, and the four particles, each with a different quantum number, like the electrons in the helium atom, are all most likely to be found in the same space, at the exact center of the nucleus. (For more complicated nuclei this is not the case. Thanks to Åke Back.)
Top: Expected results of Rutherford's gold foil experiment: alpha particles passing through the plum pudding model of the atom undisturbed. Bottom: Observed results: Some of the particles were deflected, and some by very large angles. Rutherford concluded that the positive charge of the atom must be concentrated into a very small location: the atomic nucleus.

