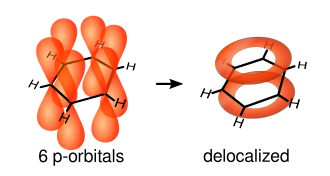Aromaticitet

Inom kemin innebär aromaticitet att en molekyl har en cyklisk (dvs ringformad) struktur med pibindningar i resonans med varandra (elektronerna i pi-bindningarna är delokaliserade).[1] Aromatiska system ger ökad stabilitet i jämförelse med föreningar som har samma uppsättning av atomer men som har ickecyklisk struktur. Aromatiska system/ringar är generellt sett stabila och går inte sönder lätt, samt att strukturens stabilitet leder till kemiska reaktionsvägar som skiljer sig från andra organiska föreningar. Organiska föreningar som inte är aromatiska klassificeras som alifatiska föreningar - de kan vara cykliska, men bara aromatiska ringar har förbättrad stabilitet. Termen aromaticitet med denna betydelse är historiskt relaterad till konceptet att ha en arom, men är en distinkt egenskap från den betydelsen.[2]
Då de vanligaste aromatiska föreningarna är föreningar som härstammar från bensen (ett aromatiskt kolväte som är vanligt i bland annat petroleum), så hänvisar termen aromatiskt ofta till föreningar som innehåller bensenringar. Det finns många aromatiska föreningar som inte innehåller bensen ringar. Till exempel inom levande organismer, där de vanligaste aromatiska ringarna är de dubbelringade baserna (Purin) i RNA och DNA. Inom organisk kemi kallas en aromatisk funktionell grupp för en arylgrupp.
Den elektroniska strukturen av en aromatisk förening, beskrivs ofta i formen av en Lewisstruktur med alternerande enkel och dubbelbindningar (konjugerat system) inom en cyklisk struktur. Egentligen är elektronerna inte exklusivt i en enkel eller dubbelbindning, utan de är jämnt fördelade över hela ringen ("delokaliserade"), detta leder till en ökad stabilitet av föreningen. På grund av begränsningarna av hur en Lewis-struktur ritas, kan molekylen inte representeras av en struktur, utan snare som en blandning av flera olika strukturer (kallad resonans), till exempel med de två resonansstrukturerna av bensen. Ingen av resonansstrukturerna av föreningarna kan detekteras i naturen, med de längre enkelbindningarna på en plats och den kortare dubbelbindningen på en annan (se § Teori nedan). Istället uppvisar föreningen att alla bindningslängder är lika långa, med en längd som är mellan de längder som är typiska för enkel- och dubbelbindningar. Denna vanliga modell av aromatiska ringar, nämligen modellen att bensen bildades från en kolring med 6 kol-atomer med omväxlande enkel- och dubbelbindningar (cyklohexatrien), utvecklades av August Kekulé. Modellen för bensen består av två resonansformer, vilket motsvarar en superposition av dubbel- och enkelbindningar för att producera sex stycken en och en halv-bindningar. Bensen är en mer stabil förening än vad man kan förvänta sig utan att ta hänsyn till laddningsdelokalisering.
Teori och struktur
C-C bindningslängden inom bensen är 1.40 Å, vilket indikerar att det är medelvärdet av en enkel C-C bindning och en dubbel C=C bindning.[3][2] En avbildning av bensen är den av en cirkulär π-bindningen (Armstrongs inre cykel ), där elektrondensiteten är jämnt fördelad genom en π-bindning ovanför och under ringen.
Inom valensbindningsteorimodellen bildas enkelbindningar från direkta överlappen av hybridiserade atomära sp2-orbitaler mellan kolkatomerna—dessa kallas för σ-bindningar.
För att bilda dubbelbindningar så måste det finnas direkt överlapp mellan sp^2-orbitalerna mellan två kolatomer, samt så måste det finnas fria ohybridiserade atomära p-orbitaler. Dessa fria p-orbitaler kan interagera och forma överlapp som är över och under planet av ringen. Detta överlapp mellan p-orbitaler kallas för π-bindningar. Följande diagram visar positionerna för dessa p-orbitaler:
Då elektronerna i π-bindningarna är utanför atom planet av föreningen, så kan dessa orbitaler interagera med varande, vilket tillåter elektronerna att delokaliseras.
Karaktärsdrag av aromatiska system
En aromatisk/arylring är en uppsättning av atomer som är kovalent bundna med vissa krav för att de ska räknas som aromatiskt system:
- Ett delokaliserat system med konjugerade π-elektroner, oftast som en uppsättning av alternerande enkel- och dubbelbindningar
- En Koplanar struktur, där alla atomer som bidrar till system i samma plan
- Atomerna befinner sig i en eller flera ringar
- Ett antal delokaliserade π elektroner som är jämnt, men antalet får inte vara en multipel av 4. Det vill säga 4 n + 2 π-elektroner, där n = 0, 1, 2, 3 och så vidare. Detta är känt som Hückels regel.
Enligt Huckels regel är en molekyl aromatisk ifall den innehåller 4 n + 2 π-elektroner. Ifall molekylen uppfyller kriterierna 1-3, fast innehåller 4 n π-elektroner så är molekylen anti-aromatisk. Enligt ovan kriterier så är bensen aromatisk (6 π-elektroner från 3 dubbelbindningar, samt uppfyller resterande kriterier). Cyklobutadiene, är dock en anti-aromatisk förening, ty den innehåller 4 delokaliserade π-elektroner, vilket givet är en multipel av 4. Dock så är cyklobutadiene(2-) jonen aromatisk (6 delokaliserade π-elektroner). Atomer i aromatiska system kan ha elektroner som inte ingår i aromatiska systemet, och kringgår därmed 4 4 n + 2 regeln. T.ex. i furan är syre atomen sp^2 hybridiserad, det ena fria elektronparet ingår i det delokaliserade π-systemet. Det andra elektronparet är i samma plan som molekylen (Liknande C-H bindningarna i de andra positionerna), och deltar därmed inte i π-systemet. Då är det 6 π-elektroner i pi systemet, och furan är aromatisk.
Aromatiska föreningar har ofta ökad kemisk stabilitet i jämförelse med liknande icke-aromatiska molekyler.
En molekyl som kan förändras till att vara aromatisk tenderar att förändras i riktningen för att bli aromatisk. Stabiliteten som tillkommer förändrar de kemiska egenskaperna av molekylen. Aromatiska system har andra reaktionsmekanismer jämfört med andra organiska föreningar med konjugerade system. T.ex. så genomgår aromatiska system elektrofila aromatiska substitutionsreaktioner och nukleofila aromatiska substitutionsreaktioner, men genomgår inte elektrofila additionsreaktioner som dubbelbundna C=C bindningar genomgår.
I närvaron av ett externt magnetfält producerar de delokaliserade och kringgående π-elektronerna i en aromatisk förening en aromatisk ringström. Denna ringström som uppkommer på grund av rörelsen av elektroner inducerar ett eget magnetiskt fält, vilket som kan identifieras inom kärnmagnetisk resonans.[4]
Kärnmagnetisk resonans (NMR- Nuclear Magnetic Resonans på engelska) signalen för protoner i planet av ett aromatisk system skiftar signifikant nedåt i jämförelse med protoner kopplade till icke-aromatiska sp^2 kol. Denna karaktäristiska skift av aromatiska protoner används ofta för struktur bestämning av organiska föreningar, och speciellt vid bestämning av aromatiska föreningar. Via samma mechanism så skiftar signalen av protoner som är nära axeln av förening uppåt.
Aromatiska föreningar kan också interagera med varandra via π-interaktioner som kallas π stapling. De närliggande π-systemen bildar två ringar som är parallella mot varandra, i en "ansikte mot ansikte" orientering. De kan likväl interagera med varandra i så "kant-till-ansikte" orientering: Där den svaga positiva laddningen av en substituent på ringen attraheras av den svaga negativa laddningen av det aromatiska systemet på en annan molekyl.
Planära monocykliska molekyler som uppfyller kriterier 1-3 men innehåller 4 n π-elektroner kallas för antiaromatiska, och är i allmänhet instabila. Anti-aromatiska molekyler tenderar att genomgå förändringar i geometri och elektronisk uppsättning för att undvika instabiliteten av anti-aromaticitet, och därav bilda icke-aromatiska föreningar. Som ett exempel så ändrar cyklooktatetraen (COT) sin geometri från en plan struktur till en böjd konfiguration. Detta bryter π-systemets delokalisering, och därav gör molekylen icke-aromatisk. Nyligen genomförda studier har visat att cyklobutadiene förvränger sin geometri så att den får en asymmetrisk, avlång uppsättning, där enkel och dubbelbindningar faktiskt alternerar i molekylen, och därav ingen resonans. Detta minskar den ogynnsamma delokalisering av π-systemet, och minskar anti-aromaciteten av molekylen. Minskningen av symmetrin i molekylen leder också till att de icke bindande och degenerata orbitalerna(orbitaler med samma energinivå) förvrängs och är icke längre degenerata. Detta leder till, via Hunds regel, att de två oparade elektronerna förflyttas till en ny, svagt bindande orbital. Från detta fås att cyklobutadiene är icke-aromatisk, instabiliteten av det asymmetriska konfigurationen väger upp för den anti-aromatiska destabiliseringen som drabbar den symmetriska konfigurationen.
Hückels regel för aromacitet håller för molekyler i deras singlettgrundtillstånd (S0 ). Trenderna för stabilitet är omvända för aromatiska föreningar i deras lägst liggande exciterade triplet- och singlet tillstånd (T1 och S1 ). Reglerna för aromacitet i det första exciterade tillståndet kallas för Bairds regeln, och säger att molekyler som har 4 n π elektroner är aromatiska i första exciterade tillståndet. Detta leder också till föreningar som är aromatiska i grundtillståndet med 4 n + 2 π-elektroner, blir anti-aromatiska i exciterade tillstånd, och förvränger ofta sin geometri för att underlätta anti-aromatiska instabiliteten.[5]
Referenser
- ^ Zhdankin, Viktor. Organic Chemistry. Cognella
- ^ [a b] Reusch, William (5 maj 2013). ”Aromaticity”. Virtual Textbook of Organic Chemistry. www2.chemistry.msu.edu. https://www2.chemistry.msu.edu/faculty/reusch/VirtTxtJml/react3.htm.
- ^ ”Bonding in benzene – the Kekulé structure”. www.chemguide.co.uk. http://www.chemguide.co.uk/basicorg/bonding/benzene1.html.
- ^ Merino, Gabriel; Heine, Thomas; Seifert, Gotthard (2004). ”The Induced Magnetic Field in Cyclic Molecules”. Chemistry: A European Journal 10 (17): sid. 4367–71. doi:. PMID 15352120.
- ^ Rosenberg, Martin; Dahlstrand, Christian; Kilså, Kristine; Ottosson, Henrik (28 maj 2014). ”Excited State Aromaticity and Antiaromaticity: Opportunities for Photophysical and Photochemical Rationalizations”. Chemical Reviews 114 (10): sid. 5379–5425. doi:. ISSN 0009-2665. PMID 24712859.
Media som används på denna webbplats
Författare/Upphovsman: Vladsinger, Licens: CC BY-SA 3.0
Orbital hybridization in benzene rings.
Författare/Upphovsman: An elite, Licens: CC BY-SA 3.0
Benzene molecule. Hydrogen atoms are shown, and π bonds are shown as delocalized.