Aminosyror
| Ämnesomsättningen | |
Denna artikel är en del i serien Ämnesomsättningen med följande delar: | |
| Metabolism · Katabolism · Anabolism | |
| Katabolism | |
|---|---|
| Matspjälkning · Glykolys · Beta-oxidation · Trans-/Deaminering · Citronsyracykeln · Elektrontransportkedjan · Oxidativ fosforylering · Ureacykeln | |
| Anabolism | |
| Glukoneogenes · Proteinsyntes · Fettsyrasyntes | |
| Se även | |
| Fotosyntes · Cellandning · Malat-aspartatskytteln |

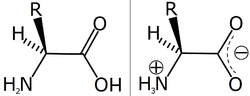
En aminosyra är en kemisk förening som innehåller både en aminogrupp och en karboxylgrupp. Inom biokemin syftar ordet oftast på de 21 aminosyror som proteiner bildas av hos däggdjur (det totala antalet kända naturliga aminosyror överstiger 300).[1] Proteiner är polymerer av alfa-aminosyror, som hålls ihop av peptidbindningar mellan kolet i en karboxylgrupp och kvävet i aminogruppen på nästa aminosyra.[1] I alfa-aminosyrorna, som även utanför proteiner är de vanligaste aminosyrorna, är amingruppen bunden till den första kolatomen, alfa-kolet, efter karboxylgruppen. Alfa-kolet är också bundet till en väteatom och till en sidokedja, som är speciell för respektive aminosyra. Aminosyrorna som bildar proteiner har primära amingrupper med undantag för prolin, som har en sekundär amingrupp och ibland räknas som en iminosyra.[1]
Aminosyror brukar vanligen delas in i grupper efter sidokedjornas egenskaper: sura, basiska, hydrofila (eller polära) och hydrofoba (eller opolära). Alla aminosyror är amfolyter, då de både kan ta upp och avge protoner. Karboxylgruppen kan avge en proton till amingruppen, då aminosyran bildar en amfojon, även kallat zwitterjon. Zwitterjonen är amfolyt och dipolär. Vid den isoelektriska punkten föreligger alltså nettoladdning noll.
Essentiella aminosyror är aminosyror som kroppen inte kan tillverka genom att bygga om andra aminosyror och som därför måste tillföras via kosten.
Grenade aminosyror (BCAA) är en grupp essentiella aminosyror vars struktur inkluderar en sidokedja med en kolatom och tre väteatomer.[2]
Omvandling av aminosyror
Alla aminosyror kan omvandlas till karboxylsyror genom att ta bort dess aminogrupp. Detta kan ske genom två olika metoder, transaminering och deaminering. Transaminering innebär att aminogruppen förs över från aminosyran till en karboxylsyra enligt formeln:
- aminosyra1 + karboxylsyra2 karboxylsyra1 + aminosyra2
Vid syntes av de flesta aminosyrorna används detta genom transaminering av glutamat eller glutamin till karboxylsyror som frigjorts i olika mellansteg av metabolismen.
Om det istället finns ett överskott av aminosyror så kan de deamineras, vilket innebär att aminosyran oxideras till en karboxylsyra och ammoniumjoner som är mycket giftiga och omedelbart görs till urinämne.
Karboxylsyrorna som kommer från de- och transamineringen kan sedan antingen skapas om till aminosyror igen eller brytas ner. Flera kan ingå i citronsyracykeln medan andra får andra nedbrytningsvägar.
Indelning

Aminosyror delas in fyra eller fem grupper med avseende på sina sidokedjor. De fyra är:
- Icke-polära sidokedjor (hydrofob)
- Polära sidokedjor (hydrofil)
- Sura sidokedjor
- Basiska sidokedjor
De sura sidokedjorna (karboxyl-syra) är negativt laddade i neutrala miljöer.
En kemiskt användbar aminosyra är histidin som kan fås att byta laddning. Ett exempel på användningsområde är histidin-tagg vid rening av proteiner med hjälp av kolonn. Då kan man först hälla i sitt blandade startmaterial och få analyten att fästa till kolonnen (tex. positiv analyt binder till negativt histidin i kolonnen). Sedan byter man laddning på histidin som då vid sköljning av kolonnen släpper ifrån sig den isolerade substansen.
2 aminosyror bildar en dipeptid, 3 aminosyror bildar en tripeptid och så vidare. Mer än 10 aminosyror bildar en polypeptid, och mer än 50–100 aminosyror bildar ett protein. Aminosyror i en peptid eller ett protein kallas för aminosyrarest.
Kemiska egenskaper
Den här tabellen visar för varje aminosyra i proteiner:
- Vanligt förekommande en-bokstavs-förkortning
- Vanligt förekommande tre-bokstavs-förkortning
- Sidogruppens kemiska egenskaper
| Förkortn. | Fullständigt namn | Typ av sidogrupp | Molmassa [g/mol] | Ip | pKa1 (α-COOH) | pKa2 (α-+NH3) | pKaR (R) | Kommentarer | |
|---|---|---|---|---|---|---|---|---|---|
| A | Ala | Alanin | hydrofob | 89,09 | 6,11 | 2,35 | 9,87 | ||
| C | Cys | Cystein | hydrofil | 121,16 | 5,05 | 1,92 | 10,70 | 8,37 | I oxiderande miljö kan två cysteiner binda kovalent till varandra, disulfidbindning. Denna bindning stabiliserar proteiners tertiärstruktur, till exempel i insulin. |
| D | Asp | Asparaginsyra | syra | 133,10 | 2,85 | 1,99 | 9,90 | 3,90 | |
| E | Glu | Glutaminsyra | syra | 147,13 | 3,15 | 2,10 | 9,47 | 4,07 | |
| F | Phe | Fenylalanin | hydrofob | 165,19 | 5,49 | 2,20 | 9,31 | ||
| G | Gly | Glycin | hydrofob | 75,07 | 6,06 | 2,35 | 9,78 | Eftersom α-kolet binder till två lika "grupper", väteatomer, är glycin inte optiskt aktivt. | |
| H | His | Histidin | basisk | 155,16 | 7,60 | 1,80 | 9,33 | 6,04 | |
| I | Ile | Isoleucin | hydrofob | 131,17 | 6,05 | 2,32 | 9,76 | ||
| K | Lys | Lysin | basisk | 146,19 | 9,60 | 2,16 | 9,06 | 10,54 | |
| L | Leu | Leucin | hydrofob | 131,17 | 6,01 | 2,33 | 9,74 | ||
| M | Met | Metionin | hydrofob | 149,21 | 5,74 | 2,13 | 9,28 | Syntesen (tillverkningen) av nya proteiner i cellerna börjar alltid med en metionin. I många fall tas denna bort i senare processer. | |
| N | Asn | Asparagin | hydrofil | 132,12 | 5,41 | 2,14 | 8,72 | ||
| P | Pro | Prolin | hydrofob | 115,13 | 6,30 | 1,95 | 10,64 | Den enda aminosyran där N-terminalen innehåller ett väte istället för två. | |
| Q | Gln | Glutamin | hydrofil | 146,15 | 5,65 | 2,17 | 9,13 | ||
| R | Arg | Arginin | basisk | 174,20 | 10,76 | 1,82 | 8,99 | 12,48 | |
| S | Ser | Serin | hydrofil | 105,09 | 5,68 | 2,19 | 9,21 | ||
| T | Thr | Treonin | hydrofil | 119,12 | 5,60 | 2,09 | 9,10 | ||
| V | Val | Valin | hydrofob | 117,15 | 6,00 | 2,39 | 9,74 | ||
| W | Trp | Tryptofan | hydrofob | 204,23 | 5,89 | 2,46 | 9,41 | ||
| Y | Tyr | Tyrosin | hydrofil och hydrofob[källa behövs] | 181,19 | 5,64 | 2,20 | 9,21 | 10,46 | |
Referenser
Noter
- ^ [a b c] Champe, Pamela C. (2008). Biochemistry (4th ed). Wolters Kluwer Health/Lippincott Williams & Wilkins. ISBN 978-0-7817-6960-0. OCLC 134991023. https://www.worldcat.org/oclc/134991023. Läst 6 december 2020
- ^ ”All About BCAAs | Precision Nutrition” (på amerikansk engelska). Precision Nutrition. 15 december 2008. http://www.precisionnutrition.com/all-about-bcaas. Läst 23 september 2017.
Källor
- Nationalencyklopedin 1. Bra Böcker. 1989. sid. 295. ISBN 91-7024-621-1
- Sherwood, Martin (1990). Kemin, Grundämnen & föreningar. Bonniers. sid. 110. ISBN 91-34-50893-7
- Champe, Pamela C.; Harvey Richard A., Ferrier Denise R. (2008) (på engelska). Biochemistry. Lippincott's illustrated reviews (4. ed.). Baltimore, MD: Lippincott Williams & Wilkins. Libris 10531981. ISBN 9780781769600
| |||||
Media som används på denna webbplats
Författare/Upphovsman: The original uploader was DMacks på engelska Wikipedia., Licens: CC BY-SA 3.0
Created by me in gimp by editing the GFDL'ed en:Image:Amino_acids_1.png


