Alkoholer

Alkoholer, av arabiska الكحول (transkriberat som al kohoul[1]), är organiska ämnen där en eller flera hydroxylgrupper (OH) är bundna till kolatomer i en kolkedja. Den enklaste alkoholen är metanol, CH3OH, med enbart en kolatom och en OH-grupp. Det ämne som oftast kallas alkohol i vardagsspråk är etanol, C2H5OH. Mer specifikt har alkoholer OH-gruppen eller OH-grupperna bunden till en alifatiskt bunden kolatom, d.v.s. en kolatom som ingår i en alifatisk kolkedja. Om kolkedjan är en alkan bestående av n kolatomer, har alkoholen summaformeln CnH2n+2-m(OH)m. Även alkener, alkyner, cykloalkaner och andra organiska föreningar kan bilda alkoholer, såsom etenol, cyklohexanol och 2-kloretanol. Föreningar med en hydroxigrupp bunden till aromatiskt bundna kolatomer, såsom en bensenring kallas däremot inte alkoholer utan fenoler, bensendioler och så vidare.
En kolkedja kan ha mer än en hydroxigrupp bunden till sig och kallas då en tvåvärd alkohol eller diol, trevärd alkohol eller triol o.s.v. En vanlig tvåvärd alkohol är etandiol ("glykol"), och trevärd propantriol ("glycerol"). En speciell grupp av flervärda alkoholer är sockeralkoholerna. De kemiskt närbesläktade sockerarter är flervärda alkoholer som också har en keton- eller aldehydgrupp.
Alkoholer är vanligen förekommande i naturen. Många alkoholer har omfattande teknisk användning. Etanol förekommer i spritdrycker, vin, öl och andra alkoholhaltiga drycker. Metanol är starkt giftig vid förtäring eller hudkontakt.
Struktur
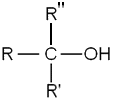
Alkoholer med flera kolatomer kan ha en av tre olika strukturer. Dessa tre typer är primära, sekundära och tertiära, vilket åsyftar antalet kolatomer som binder till den kolatom som binder till OH-gruppen. I primära alkoholer binder den OH-bindande kolatomen till endast en annan kolatom. Alkoholer med en eller två kolatomer är alltid primära alkoholer, och metanol är ett specialfall, då kolatomen inte binder till någon annan kolatom. I sekundära alkoholer binder kolatomen till två andra kolatomer. Den minsta sekundära alkoholen är 2-propanol (trivialnamn isopropanol) med tre kolatomer. I tertiära alkoholer binder kolatomen till tre andra kolatomer. Den minsta tertiära alkoholen är 2-metyl-2-propanol (trivialnamn tert-butanol). R i strukturerna nedan betecknar en kolvätegrupp. Alkoholens fysikaliska egenskaper såsom smältpunkt egenskaper påverkas av strukturen. Trivialnamnet på sekundära alkoholer börjar ibland på iso- (för isomer), t.ex. isopropanol.
| Primära alkoholer | Sekundära alkoholer | Tertiära alkoholer |
Nomenklatur
En alkohols namn kommer av att man lägger till -ol till namnet på det kolväte som oxideras till just den alkoholen. I handeln förekommer även trivialnamn på alkoholer, såsom glykol.
Om en organisk förening har en funktionell grupp som har högre prioritet inom nomenklaturen, anges alkoholgruppen endast med prefixet "hydroxi"-, exempelvis hydroxisyror som 2-hydroxipropansyra ("mjölksyra"), hydroxiketoner etcetera.
Lågfärg
Förbränning
När alkoholer förbränns bildas som regel en blå låga. När större alkoholmolekyler förbränns behövs mycket syre för att förbränningen ska kunna ske efter det normala skeendet. Eftersom det inte alltid finns tillgång till det nödvändiga antalet syremolekyler sker en ofullständig förbränning (CO + C + H2O) istället för en ordinär förbränning (en av orsakerna till kolmonoxidförgiftning) i vilken kolmonoxid bildas.
Efter den ofullständiga förbränningen bildas tillsammans med vatten sot, som glöder samtidigt som den avger en gulaktig färg.[2]
Reaktioner
Oxidation
Oxidation av primära alkoholer ger aldehyder och karboxylsyror, beroende på hur långt oxidationen drivs. Exempelvis ger oxidation av metanol metanal (formaldehyd) respektive metansyra (myrsyra), och oxidation av etanol ger etanal (acetaldehyd) respektive etansyra (ättiksyra).
Vid oxidation av sekundära alkoholer bildas ketoner. När tertiära alkoholer oxideras bryts molekylen sönder i mindre delar.
Estrar
Tillsammans med karboxylsyror kan alkoholer bilda estrar. Estrar är ofta ämnen med kraftiga aromer eller färger, som kan förekomma naturligt, och som ofta används som lukt- eller smakämne i bland annat godis, för fruktsmaker.
Kända alkoholer och deras egenskaper
Kända alkoholer inkluderar de två enklaste envärda alkoholerna metanol och etanol. Metanol, CH3OH, som också kallas metylalkohol eller träsprit, är mycket giftigt och uppstår vid torrdestillation av trä. Etanol, CH3CH2OH, som också kallas etylalkohol eller helt enkelt alkohol eller sprit, har verkan som rusdryck och bildas vid jäsning av sockerarter.
Den enklaste tvåvärda alkoholen är etandiol, C2H4(OH)2, som även kallas etylenglykol eller bara glykol. Etandiol är mycket giftigt, och framställs vanligen genom att etenoxid, framställd av eten genom en katalytisk reaktion, får reagera med vatten.
Den enklaste trevärda alkoholen är propantriol, C3H5(OH)3, som även kallas glycerol eller glycerin. Propantriol framställs genom förtvålning av fetter.
Enklare alkoholer som metanol, etanol och propanol (CH3CH2CH2OH) samt några flervärda alkoholer som etandiol (glykol) och propantriol (glycerol) är lättlösliga i vatten och är vid rumstemperatur färglösa vätskor, medan tyngre alkoholer är vanligen fasta. Metanol, etanol och propanol har en karakteristisk lukt och brinner med klar, blå låga.
Även om alkoholer innehåller OH-grupper och chans till vätebindningar finns, kan alkoholer då vara svårlösliga. En faktor till detta är lång kolkedja. Dominerar kolkedjan minskas polariteten och även vattenlösligheten.
Användning
Alkoholer kan bland annat användas som desinfektionsmedel och är också bra lösnings- och rengöringsmedel, speciellt i avfettningssammanhang.
Etanol används som tillsats i bilbränsle då det ansetts vara mer miljövänligt än bensin. De vanligast förekommande blandförhållandena är E10 och E85, det vill säga tio respektive 85 procents tillsättning av etanol. E10 är vanlig bensin och E85 kallas oftast bara etanol.
Etanol förekommer i spritdrycker, vin, öl och andra alkoholdrycker, samt i mindre mängd i vissa livsmedel.
Se även
Källor
| ||||||||||||||||||||
|
Media som används på denna webbplats
Författare/Upphovsman: Gabriel Tojo, Licens: CC BY 2.5
Oxidation of primary alcohol to carboxylic acid via aldehyde
Författare/Upphovsman: Pinpin, Licens: CC-BY-SA-3.0
Réaction entre un acide carboxylique et un alcool