Alkoholdehydrogenas
Struktur
Alkoholdehydrogenas är ett protein som består av cirka 267 aminosyror[1]. Aminosyrorna är uppdelade på två identiska subenheter med varsin domän som representerar den aktiva ytan hos reaktionen[2]. Varje subenhet innehåller två zinkjoner, där den ena behövs för att stabilisera proteinet medan den andra zinkjonen är katalytisk och fungerar som den elektrofila delen hos den aktiva ytan. Zinkjonerna binder till proteinet med hjälp av fyra bindningar som går till aminosyrorna “Cys” och “His”. Den katalytiska zinkjonen binder däremot till en vattenjon istället för den fjärde aminosyran.
När ADH inte katalyserar en reaktion befinner enzymet i en “stängd” form där zinkjonerna är skyddade.[3] Detta är på grund av att kväveoxid (NO) fungerar som en inhibitor för reaktioner med ADH då kväveoxid reagerar med zinkjonen och gör enzymet värdelöst. Kväveoxid är en kompetitiv inhibitor, vilket innebär att kväveoxid tävlar om att reagera med ADH före NAD+ och alkoholen.[4]
Faktumet att ADH skyddar zinkjonen är extra viktig under alkoholkonsumtion, då ökad alkoholkonsumtion leder till att kroppen producerar en större mängd kväveoxid än i vanliga fall.[3]
Reaktioner
Reaktionsförloppet
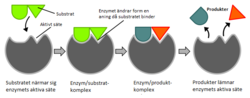
ADH har en lucka som är lika laddad. Det gör att även när det inte sker någon reaktion finns det fortfarande plats för att en reaktion senare ska kunna ske. När koenzym NAD+ och en alkohol reagerar med ADH så öppnas luckan mellan de två domänerna.[3] Sulfatet hos NAD+ binder till enzymet samtidigt som den katalytiska zinkjonen flyttas närmare koenzymets bindningsyta. Vattenmolekylen hos zinkjonen byts ut mot alkoholen i reaktionen. När båda substraten har bundit till enzymet sluter enzymet sig runt om substraten. Inuti ADH binder alkoholen till både zinkjonen och NAD+ vilket gör det möjligt för väte och elektroner att förflytta sig från alkoholen över till NAD+ som blir NADH + H+. När reaktionen är färdig “öppnar” sig enzymet igen och släpper ut produkterna, i detta fall en aldehyd och NADH + H+
Reaktion med metanol
Alkoholdehydrogenas (ADH) är ett enzym som bryter ner olika alkoholer till aldehyder i den mänskliga kroppen.[5] Metanol oxideras med hjälp av alkoholdehydrogenas till formaldehyd (metanal) som sedan oxideras vidare av kroppen till myrsyra. Myrsyra och formaldehyd är giftigare än metanol och kan påverka kroppens pH så att man hamnar i sjukdomstillståndet acidos.[6] Dagens läkare försöker motverka kroppens försök att oxidera metanol genom att ge patienter inhibitorer i form av utspädd etanol, vilket ger levern och njurarna tid att transportera vidare metanolet innan det oxideras till en farligare produkt för oss människor.
Reaktion med etanol
Etanol tas upp av blodet via magsäcken och tunntarmens väggar efter ha konsumerats.[7] Därifrån transporteras etanolet via blodet till levern och njurarna där etanolet oxideras till acetaldehyd (etanal). Acetaldehyd oxideras vidare till ättiksyra (etansyra) som slutligen oxideras till koldioxid, vatten och energi, vilket är ofarligt för vår kropp.
Oxidationsreaktionen från alkohol till acetaldehyd:
- CH3CH2OH + NAD+ → CH3CHO + NADH + H+
Resterna i kroppen
Kroppens alkoholdehydrogenas har inte så stor kapacitet; det mättas redan vid låga halter alkohol i blodet, ungefär 0,1 promille. Därför eliminerar enzymet alkohol ur kroppen enligt nollte ordningens kinetik, dvs. halten minskar med ett visst antal promilleneheter per tidsenhet, oberoende av den aktuella koncentrationen. En tumregel är att alkoholdehydrogenas eliminerar 0,1 g etanol per timme per kilogram kroppsvikt.[7] Det vill säga för varje kilo individen väger kommer cirka 0,1 g etanol att försvinna varje timme. En person på 70 kg kommer alltså bli av med cirka 7 g etanol på en timme, ungefär mängden etanol som finns i en lättöl.
Enzymellt tillhör alkoholdehydrogenas IUBMB-klass nummer ett, oxidoreduktaser, med enzymnummer 1.1.1.1, eftersom det katalyserar en oxidationsreaktion.
Mätmetoder
Spektrofotometri
Alkoholdehydrogenas kan undersökas med hjälp av en spektrofotometer tack vare koenzymet NADH+.[2] Efter att ADH har regerat med en alkohol och NAD+, tar koenzymet NAD+ upp väte och elektroner och blir NADH. NADH absorberar ultraviolett ljus med våglängden 340 nm vilket gör det möjligt att följa reaktionen.
Referenser
- ^ ”Crystal structure of 15-hydroxyprostaglandin dehydrogenase type1, complexed with NAD+”. Protein Data Bank in Europe. https://www.ebi.ac.uk/pdbe/entry/pdb/2gdz. Läst 10 april 2020.
- ^ [a b] Ljung, Johanna (2004). Kroppens kemi. sid. 113. Läst 10 april 2020
- ^ [a b c] ”ALKOHOLNEDBRYTNING OCH DESS EFFEKTER I KROPPEN”. Arkiverad från originalet den 1 februari 2020. https://web.archive.org/web/20200201022409/http://xray.bmc.uu.se/Courses/Bke1/1998/Projects/Alcohol/Alko.html. Läst 23 april 2020.
- ^ Henriksson, Anders (2012). Syntes Kemi 2. sid. 175. Läst 23 april 2020
- ^ ”Alcohol”. Britannia school. https://school.eb.co.uk/levels/advanced/article/alcohol/5513#277692.toc. Läst 10 april 2020.
- ^ Otto Zeidler, Gunilla, Jakobsson (2006). Humankemi. sid. 33. Läst 10 april 2020
- ^ [a b] Henriksson, Anders (2012). Syntes kemi 2. sid. 84. Läst 10 april 2020
Media som används på denna webbplats
Diagram, with Swedish captions, illustrating the induced fit model of enzyme activity.
Författare/Upphovsman: Niesen FH, Schultz L, Jadhav A, Bhatia C, Guo K, Maloney DJ, Pilka ES, Wang M, Oppermann U, Heightman TD, Simeonov A, Licens: CC BY-SA 4.0
Visar strukturen för enzymet alkoholdehydrogenas i atomform. De olika färgerna reprensenterar olika atomer där rött är syre, gråt är kol samt blåt är kväve.
Författare/Upphovsman: Niesen FH, Schultz L, Jadhav A, Bhatia C, Guo K, Maloney DJ, Pilka ES, Wang M, Oppermann U, Heightman TD, Simeonov A, Licens: CC BY-SA 4.0
Bilden visar tertiärstrukturen för enzymet alkoholdehydrogenas samt några viktigare delar som den aktiva ytan och a-helix.