Alfa 2-makroglobulin
Alfa-2-makroglobulin även känt som α2-makroglobulin och ibland förkortat som α2M eller A2M är ett stort plasmaprotein i blodet. Det produceras huvudsakligen av levern men syntetiseras även lokalt av makrofager, fibroblaster och adrenokortikala celler. Det är en huvudkomponent i alfa-2-bandet vid proteinelektrofores. Hos människor kodas det av A2M-genen.
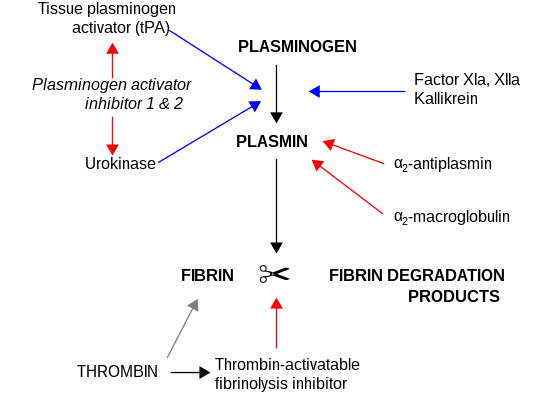
α2-makroglobulin fungerar som ett antiproteas och kan inaktivera en stor mängd proteinaser. Det fungerar som en hämmare av fibrinolys genom att hämma plasmin och kallikrein. Det fungerar som en hämmare av koagulering genom att hämma trombin. α2-makroglobulin kan fungera som ett bärarprotein eftersom det också binder till många tillväxtfaktorer och cytokiner, såsom trombocythärledd tillväxtfaktor, grundläggande fibroblasttillväxtfaktor, TGF-β, insulin och IL-1β.
Struktur
Humant α2-makroglobulin består av fyra identiska underenheter bundna av -S-S-bindningar.[1][2] Förutom tetramera former av α2-makroglobulin har dimeriska och på senare tid monomera αM-proteashämmare identifierats.[3][4]
Varje monomer av humant α2-makroglobulin består av flera funktionella domäner, inklusive makroglobulindomäner, en tiolesterinnehållande domän och en receptorbindande domän.[5] Sammantaget är α2-makroglobulin det största stora icke-immunglobulinproteinet i human plasma.
Aminosyrasekvensen för α2-makroglobulin har visat sig vara 71 procent densamma som för graviditetszonproteinet PZP, även känt som graviditetsassocierat α2-makroglobulin.[6]
Funktion
α-makroglobulinfamiljen (αM) av proteiner inkluderar proteashämmare,[7] kännetecknad av den humana tetramera α2-makroglobulin (α2M). De tillhör MEROPS proteinashämmare familj I39, klan IL. Dessa proteashämmare delar flera definierande egenskaper, som inkluderar
- (1) förmågan att hämma proteaser från alla katalytiska klasser,
- (2) närvaron av en "beteregion" (även känd som en sekvens av aminosyror i en α2-makroglobulinmolekyl, eller ett homologt protein, som innehåller scissila peptidbindningar för de proteinaser som den hämmar) och en tiol ester,
- (3) en liknande proteashämmande mekanism och
- (4) inaktivering av den hämmande kapaciteten genom reaktion av tiolester med små primära aminer.
αM-proteashämmare hämmar genom steriskt hinder.[8] Mekanismen involverar proteasklyvning av betesområdet, ett segment av αM som är särskilt mottagligt för proteolytisk klyvning, vilket initierar en konformationsförändring så att αM kollapsar om proteaset. I det resulterande αM-proteaskomplexet är det aktiva stället för proteaset steriskt avskärmat, vilket väsentligt minskar tillgången till proteinsubstrat. Ytterligare två händelser inträffar som en följd av klyvning i betesområdet, nämligen
- (1) h-cysteinyl-g-glutamyltiolestern blir mycket reaktiv och
- (2) en större konformationsförändring exponerar en bevarad COOH-terminal receptorbindningsdomän[9] (RBD).
RBD-exponering gör att αM-proteaskomplexet kan binda till rensningsreceptorer och avlägsnas från cirkulationen.[10] Tetramera, dimera och på senare tid monomera αM-proteashämmare har identifierats.[3][4]
α2-makroglobulin kan inaktivera en stor mängd proteinaser såsom serin-, cystein-, asparaginsyra- och metalloproteinaser. Det fungerar som en hämmare av fibrinolys genom att hämma plasmin och kallikrein. Det fungerar som en hämmare av koagulering genom att hämma trombin.[11] α2-makroglobulin har i sin struktur en 35 aminosyra "bete"-region. Proteinaser som binder och klyver betesområdet blir bundna till α2M. Proteinas-α2M-komplexet känns igen av makrofagreceptorer och rensas från systemet.
α2-makroglobulin är känt för att binda zink, liksom koppar i plasma, ännu starkare än albumin, och som sådant är det också känt som transcuprein.[12] 10 till 15 procent av koppar i human plasma kelateras av α2-makroglobulin.[13]
Sjukdom
α2-makroglobulinnivåerna ökar när serumalbuminnivåerna är låga,[14] vilket oftast ses vid nefrotiskt syndrom, ett tillstånd där njurarna börjar läcka ut några av de mindre blodproteinerna. På grund av sin storlek behålls α2-makroglobulin i blodomloppet. Ökad produktion av alla proteiner innebär α2-makroglobulinkoncentrationen ökar. Denna ökning har liten negativ effekt på hälsan, men används som en diagnostisk ledtråd.
En vanlig variant (29,5 procent) (polymorfism) av α2-makroglobulin leder till ökad risk för Alzheimers sjukdom.[15][16]
α2-makroglobulin binder till och tar bort de aktiva formerna av gelatinaset (MMP-2 och MMP-9) från cirkulationen via scavengerreceptorer på fagocyterna.
Referenser
- Den här artikeln är helt eller delvis baserad på material från engelskspråkiga Wikipedia, Alpha-2-Macroglobulin, 18 mars 2022.
- McPherson & Pincus: Henry's Clinical Diagnosis and Management by Laboratory Methods, 21st ed.
- Firestein: Kelley's Textbook of Rheumatology, 8th edition.
Noter
- ^ ”Low resolution X-ray structure of human methylamine-treated alpha 2-macroglobulin”. J. Biol. Chem. 270 (42): sid. 25133–41. October 1995. doi:. PMID 7559647.
- ^ ”Primary structure of human alpha 2-macroglobulin. V. The complete structure.”. J Biol Chem 259 (13): sid. 8318–27. 1984. doi:. PMID 6203908.
- ^ [a b] ”The phylogeny and evolution of the thioester bond-containing proteins C3, C4 and alpha 2-macroglobulin”. Immunol. Rev. 166: sid. 15–26. December 1998. doi:. PMID 9914899.
- ^ [a b] ”Alpha2-macroglobulin: an evolutionarily conserved arm of the innate immune system”. Dev. Comp. Immunol. 23 (4–5): sid. 375–90. 1999. doi:. PMID 10426429.
- ^ ”Human alpha2-macroglobulin is composed of multiple domains, as predicted by homology with complement component C3.”. Biochem J 407 (1): sid. 23–30. 2007. doi:. PMID 17608619.
- ^ ”Primary structure of pregnancy zone protein. Molecular cloning of a full-length PZP cDNA clone by the polymerase chain reaction”. Biochimica et Biophysica Acta (BBA) - Gene Structure and Expression 1088 (1): sid. 95–103. 1991. doi:. PMID 1989698.
- ^ Sottrup-Jensen L (July 1989). ”Alpha-macroglobulins: structure, shape, and mechanism of proteinase complex formation”. J. Biol. Chem. 264 (20): sid. 11539–42. doi:. PMID 2473064.
- ^ ”Proteinase binding and inhibition by the monomeric alpha-macroglobulin rat alpha 1-inhibitor-3”. J. Biol. Chem. 264 (19): sid. 11428–35. July 1989. doi:. PMID 2472396.
- ^ ”A conserved region in alpha-macroglobulins participates in binding to the mammalian alpha-macroglobulin receptor”. Biochemistry 28 (3): sid. 1406–12. February 1989. doi:. PMID 2469470.
- ^ ”Human pregnancy zone protein and alpha 2-macroglobulin. High-affinity binding of complexes to the same receptor on fibroblasts and characterization by monoclonal antibodies”. J. Biol. Chem. 261 (35): sid. 16622–5. December 1986. doi:. PMID 2430968.
- ^ ”Alpha-2-macroglobulin functions as an inhibitor of fibrinolytic, clotting, and neutrophilic proteinases in sepsis: studies using a baboon model”. Infect. Immun. 61 (12): sid. 5035–43. December 1993. doi:. PMID 7693593.
- ^ Liu, Nanmei; Lo, Louis Shi-li; Askary, S. Hassan; Jones, LaTrice; Kidane, Theodros Z.; Nguyen, Trisha Trang Minh; Goforth, Jeremy; Chu, Yu-Hsiang; et al. (September 2007). ”Transcuprein is a macroglobulin regulated by copper and iron availability”. The Journal of Nutritional Biochemistry 18 (9): sid. 597–608. doi:. PMID 17363239.
- ^ Liu, Nan-mei; Nguyen, Trang; Kidane, Theodros; Moriya, Mizue; Goforth, Jeremy; Chu, Andy; Linder, Maria (6 March 2006). ”Transcupreins are serum copper-transporters of the macroglobulin family, and may be regulated by iron and copper” (på engelska). The FASEB Journal 20 (4): sid. A553–A554. doi:. ISSN 0892-6638.
- ^ Stevenson, FT; Greene, S; Kaysen, GA (January 1998). ”Serum alpha 2-macroglobulin and alpha 1-inhibitor 3 concentrations are increased in hypoalbuminemia by post-transcriptional mechanisms.”. Kidney International 53 (1): sid. 67–75. doi:. PMID 9453001.
- ^ ”Alpha-2 macroglobulin is genetically associated with Alzheimer disease”. Nat. Genet. 19 (4): sid. 357–60. August 1998. doi:. PMID 9697696.
- ^ Kovacs DM (July 2000). ”alpha2-macroglobulin in late-onset Alzheimer's disease”. Exp. Gerontol. 35 (4): sid. 473–9. doi:. PMID 10959035.
Externa länkar
- The MEROPS online database for peptidases and their inhibitors: I39.001
| ||||||||
Media som används på denna webbplats
(c) Jfdwolff, CC BY-SA 3.0
Fibrinolys (förenklad). Blå pilar betecknar stimulering och röda pilar hämning.