Affinitetskromatografi
Affinitetskromatografi är en kromatografisk separationsmetod där ämnet som ska adsorberas har en specifik affinitet till en ligand. Liganden är kovalent bunden till en matris (oftast en gelmatris av typen agaros). Matrisen och liganden bildar tillsammans en stationär fas (även kallad adsorbent).
En lösning (den mobila fasen) pumpas förbi adsorbentet och speciella interaktioner sker så att ämnet i den mobila fasen adsorberas och blir immobiliserat genom en svag icke-kovalent bindning. Bindningen måste vara reversibel.
Den immobiliserade molekylen kan till exempel vara en antikropp till ett visst protein. När en lösning med olika proteiner i mobilfasen sköljs igenom fastnar endast antikroppen.
Processen när det immobiliserade ämnet frigörs från liganden kallas eluering och kan utföras genom att ändra pH eller jonkoncentration.
Flera undergrupper finns inom affinitetskromatografin beroende på ligandval och vilken mekanism som skapar interaktionen:
- Bioaffinitetskromatografi
- Immobilized Metal Ion Affinity Chromatography (IMAC)
- Tiofil affinitetskromatografi
- EDAC– Electron-Donor-Acceptor Chromatography
Se även andra kromatografiska metoder
Användning
Affinitetskromatografi kan användas för att:
- Urskilja biologiska substanserna som binder till ett visst ämne.
- Rena och koncentrera ett ämne.
- Minska mängden av ett ämne i en blandning.
- Rena och koncentrera en enzymlösning.
Kanske den vanligaste användningen av affinitetskromatografi är för rening av rekombinanta proteiner.
Historia
Termen affinitetskromatografi infördes 1968 av Pedro Cuatecasas, Chris Anfinsen och Meir Wilchek i en artikel som kortfattat beskrev tekniken för enzymrening via ett immobiliserat substrat och en inhibitor. En tidig artikel 1967 av Axén, Porath & Ernback beskrev aktivering av Sepharose genom att använda en cyanogen-bromid (CNBr)-reaktion och att använda en distans (spacer) för att minska ett steriskt hinder, d.v.s. närliggande elektrongrupper repellerar varandra.
Princip
Den stationära fasen är typiskt en gelmatris, ofta av agaros, en linjär sockermolekyl vilken utvinns ur rödalger.
Normalt utgår man från lösning som innehåller olika molekylgrupper. Molekylen som ska extraheras har en känd och definierad egenskap vilket utnyttjas i affinitetsprocessen. En ligand med affinitet för molekylen kopplas genom kovalent bindning till matrisen och bildar därmed ett adsorbent.
Processen kan ses som en infångning, dvs. målmolekylen kommer att bindas till adsorbentet. Övriga molekyler i den mobila fasen kommer inte bindas eftersom de saknar målmolekylens egenskap. Adsorbentet kan sedan tvättas för att få bort överflöd av molekyler som inte bundits. Därefter frigörs målmolekylen genom ett process som kallas eluering.
Batch och kolonnprocesser
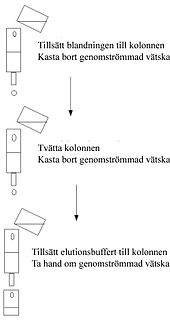
Bindningen till den stationära fasen kan åstadkommas genom kolonnkromatografi varvid den stationära fasen är packad i en vertikal kolonn.
Den mobila fasen (bufferten) får rinna igenom kolonnen och varefter man tillsätter en tvättbuffert. Sist tillsätts en elueringsbuffert och vätskan som tas om hand. Detta görs oftast vid normalt lufttryck.
Alternativt kan en batchbehandling användas, t.ex. genom att tillföra den mobila fasen tillsammans med adsorbentet i ett kärl, blanda, separera adsorbentet, avlägsna den mobila fasen, tvätta, centrifugera,tillsätta elueringsbufferten, centrifugera och avskilja eluatet.
En hybridmetod kan användas där bindningensker genom den batchmetod och adsorbentet med den bundna målmolekylen är packad i kolonnen och där tvättningen och elueringen utförs i kolonnen.
En tredje metod, expanderad bäddadsorption, kombinerar fördelarna med de två metoderna som nämns ovan. Adsorbentpartiklarna placeras i en kolonn där vätskefasen pumpas in från bottnen och ut i toppen. Gravitationskraften på partiklarna gör att adsorbentet inte följer med vätskeströmmen.
Materialegenskaper
Traditionellt har porösa material använts, såsom agaros, polymetaakrylat, polyakrylamid, cellulosa och kisel. Andra materialtyper är under utveckling och dessa bygger på icke-porösa material, membranteknik, genomströmmingsbäddar och expanderande bäddar.
Expanderande bäddar är konstruerade för att förhindra blockerande packning av adsorbentet genom att vända på flödet under tvättprocessen.
Oavsett vilken typ som används så måste ett antal egenskaper beaktas när man väljer adsorbentmaterial, t.ex. kemisk reaktionströghet, kemisk stabilitet, mekanisk stabilitet samt por- och partikel-storlek.
Referenser
- Affinity Chromatography: Principles and Applications
- Expanded bed chromatography. Bioseparation, 8, sid. 1-271
- bioWORLD, Concavallin A –Specifically binds to mannosyl and glucosyl residues of polysacharides andglycoproteins. See MSDS
- GE Healthcare Life Sciences. Immobilized lectin
- Chemical Coupling of Peptides and Proteins to Polysaccharides by Means of Cyanogen Halides, Nature 214, p 1302-1304
Se även
Media som används på denna webbplats
Författare/Upphovsman: Jorpor, Licens: CC BY-SA 3.0
Principiell koppling av matris och ligand